服務(wù)熱線
177-5061-9273

中文名稱:紫蘇醇
中文同義詞:紫蘇醇;芥子醇;L-紫蘇醇;紫蘇醇標(biāo)準(zhǔn)品;紫蘇醇對(duì)照品;紫蘇醇25G;紫蘇醇、L-紫蘇醇、芥子醇、1-羥甲基-4-異丙烯基-1-環(huán)己烯
CAS號(hào): 536-59-4
英文名稱: Perilla alcohol
英文同義詞:perilla; Perillol;(S)-(-)-PeriL;perillalcohol;1-perillalcohol; Perilla alcohol;; Perillic alcohol; 1,8-p-Menthadien-7-ol; L-(-)-Perilly Alcohol
CBNumber: CB0695703
分子式: C10H16O
分子量: 152.23
紫蘇醇的分子結(jié)構(gòu)式
紫蘇醇化學(xué)性質(zhì)
熔點(diǎn): 271-272°C
沸點(diǎn): 119-121°C 11mmHg(lit.)
密度: 0.96g/mL at 25°C(lit.)
FEMA: 2664 (p-Mentha-1,8-dien-7-ol)
折射率: n20/D1.501(lit.)
閃點(diǎn): >230°F
儲(chǔ)存條件: Inertatmosphere,2-8°C
酸度系數(shù)(pKa):14.85±0.10(Predicted)
JECFA Number: 974
紫蘇醇性質(zhì)、用途與生產(chǎn)工藝
概述
紫蘇醇學(xué)名4-異丙烯基-1-環(huán)己烯甲醇,有似芳樟醇和松油醇味的稠粘油液,存在于姜草油、青檸檬油、雜薰衣草油和留蘭香等油中。因具有芳香味道,常被用作食用香精和添加劑的調(diào)配劑。紫蘇醇作為一種治療及預(yù)防癌癥的單萜類藥物,在腫瘤如卵巢腫瘤、食道癌、乳腺癌等的治療方面有獨(dú)到的治療效果。
理化性質(zhì)
粘稠油狀液體。有似芳樟醇和松油醇?xì)馕丁7悬c(diǎn)118-121℃ (11×133.322Pa)。相對(duì)密度 0.9690。折光率1.4996 ,[α]D-7°。性質(zhì)穩(wěn)定, 耐熱耐酸, 不易揮發(fā)。
合成方法
紫蘇醇以游離態(tài)或酯的形式天然存在于柑桔、櫻桃、薄荷、香檸檬、姜草、雜薰衣草等多種植物中,是植物甲醛、戊酸代謝途徑產(chǎn)生的單萜化合物。原則上,紫蘇醇可從天然植物精油中單離獲得,如Row等采用有機(jī)溶劑或超臨界CO2萃取提取紫蘇醇。雖然紫蘇醇存在于多種天然植物精油中,但因含量太低、分離不易而成本過(guò)高,因此化學(xué)合成紫蘇醇就顯得尤為重要。有關(guān)紫蘇醇的合成,大多采用天然存在的單萜化合物為起始原料,經(jīng)合適的化學(xué)轉(zhuǎn)化來(lái)進(jìn)行的。
1、 苧烯氧化法
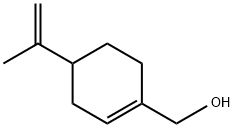
苧烯是檸檬油、甜橙油、香檸檬油、蒔蘿油等天然精油的主要成分, 因而其來(lái)源是相當(dāng)豐富的 。從分子結(jié)構(gòu)看, 苧烯與紫蘇醇具完全相同的分子骨架結(jié)構(gòu)( 圖1) , 在適當(dāng)?shù)姆磻?yīng)條件下, 苧烯可經(jīng)氧化轉(zhuǎn)化生成紫蘇醇。
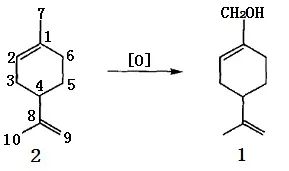
圖1 苧烯的分子結(jié)構(gòu)
空氣或氧氣對(duì)苧烯的氧化作用或催化氧化曾有廣泛的研究,二氧化硒也可對(duì)其進(jìn)行選擇性氧化。但由于苧烯氧化合成紫蘇醇是對(duì)烯丙位的甲基氫進(jìn)行氧化,而苧烯分子中有5種不同的烯丙位的氫(如圖1所示的3、4、6、7和10位上的氫),因而通常氧化反應(yīng)的產(chǎn)物十分復(fù)雜,紫蘇醇的選擇率很低。
2、β-蒎烯直接氧化法
Willing等在含有氯化亞銅、苯甲酸銅的乙腈中用過(guò)氧化二苯甲酰氧化β-蒎烯,獲得主要產(chǎn)物反式香芹醇(產(chǎn)率29.4%)和少量的紫蘇醇。夏克堅(jiān)等采用同樣的方法進(jìn)行β-蒎烯的氧化反應(yīng),紫蘇醇產(chǎn)率為73%。南京林業(yè)大學(xué)程芝等用四乙酸鉛作氧化劑,β-蒎烯經(jīng)氧化或氧化酯化、皂化制得紫蘇醇,優(yōu)化條件下紫蘇醇收率可達(dá)45%。直接氧化法所得紫蘇醇產(chǎn)率太低,且產(chǎn)物十分復(fù)雜,難以分離提純,因此應(yīng)用價(jià)值不大。
3、以α-蒎烯為原料合成
以α-蒎烯為原料(4)合成紫蘇醇有2種方法,其一是以二氧化硒SeO2為氧化劑在醋酸-醋酐混合溶劑中發(fā)生烯丙位選擇氧化或氧化-酯化反應(yīng),生成桃金娘烯醇(5a)及其乙酸酯(5b),再經(jīng)異構(gòu)化、皂化即得1。
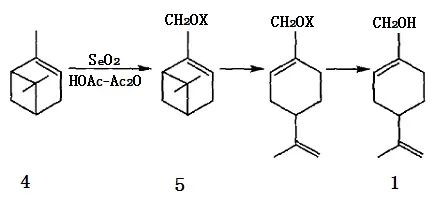
圖2 α-蒎烯用SeO2 氧化合成紫蘇醇
4、β-蒎烯環(huán)氧化物重排法
Bluthe等利用β-蒎烯環(huán)氧化物(6)在汞離子存在下與水作用,首先生成二醇,再在稀硫酸催化下脫水后可定量地轉(zhuǎn)化成紫蘇醇;這一方法在Sy-narome等的一份專利中也有報(bào)導(dǎo),據(jù)稱紫蘇醇的得率可達(dá)98%,但反應(yīng)中硫酸汞的用量幾乎是環(huán)氧蒎烷的一倍,實(shí)為不足之處。β-蒎烯環(huán)氧化物在酯酸鈉存在下與羧酸RCOOH(R=H、Me、Et、tPr)反應(yīng)可轉(zhuǎn)化成醇和相應(yīng)酯的混合物,經(jīng)水解可制得紫蘇醇。2,10-環(huán)氧蒎烷的酸催化異構(gòu)化是綜合利用我國(guó)資源豐富的松節(jié)油中的β-蒎烯來(lái)合成紫蘇醇的最有效的途徑,由于2,10-環(huán)氧蒎烷可以很方便地由β-蒎烯經(jīng)環(huán)氧化反應(yīng)制備,這也為β-蒎烯資源的綜合利用提供了一條新途徑(圖3)。
圖3 2, 10-環(huán)氧蒎烷在酸催化下的異構(gòu)化反應(yīng)
5、紫蘇醇的生物轉(zhuǎn)化
(1)、含CYP153A6的重組微生物細(xì)胞區(qū)域選擇性羥基化(S)-檸檬烯為(S)-紫蘇醇[1]
細(xì)胞生理是決定微生物生物催化劑反應(yīng)效率的關(guān)鍵因素。為探索細(xì)胞色素P450單加氧酶CYP153A6重組惡臭假單胞菌細(xì)胞將(S)-檸檬烯羥基化轉(zhuǎn)化為(S)-紫蘇醇的有效工藝條件,對(duì)其生理參數(shù)進(jìn)行了優(yōu)化。之前報(bào)道的putida GPo12合成(S)-紫蘇醇的方法是基于復(fù)雜而敏感的辛烷攝食策略,表明了細(xì)胞生理學(xué)的關(guān)鍵作用。與之前的研究結(jié)果相比,對(duì)不同碳源的篩選表明,甘油和檸檬酸是辛烷的合適替代品,具有較高的檸檬烯羥基化活性。putida KT2440作為替代宿主菌株和檸檬酸鹽作為碳源改善了實(shí)際處理,并允許比活性增加7.5倍(22.6 U gCDW -1)。在兩液相生物轉(zhuǎn)化中,在24小時(shí)內(nèi)生產(chǎn)了4.3 g (S)-紫蘇醇Ltot (-1),與以前報(bào)道的結(jié)果相比,生產(chǎn)率提高了6倍。因此,在活微生物細(xì)胞中選擇性細(xì)胞色素p450烴類氧化功能化過(guò)程中,細(xì)胞生理與目標(biāo)生物轉(zhuǎn)化之間的關(guān)系至關(guān)重要,了解這一關(guān)系可以指導(dǎo)生物催化劑和生物過(guò)程的設(shè)計(jì)。
在本研究中,Cornelissen等詳細(xì)研究了是哪些生理參數(shù)限制了含CYP153A6的整個(gè)假單胞菌細(xì)胞催化(S)-檸檬烯羥基化為(S)-紫蘇醇(圖4),目的是開發(fā)一種高效的生物轉(zhuǎn)化過(guò)程。
雖然基于細(xì)胞色素細(xì)胞的生物氧化具有很高的工業(yè)應(yīng)用潛力,但所取得的生產(chǎn)力往往太低,不具有經(jīng)濟(jì)意義。在兩液相生物轉(zhuǎn)化中,(S)-檸檬烯轉(zhuǎn)化為(S)-紫蘇醇受細(xì)胞生理限制,而不受CYP153A6固有特性的限制。謹(jǐn)慎的宿主和碳源選擇允許休眠細(xì)胞的比活性增加7.5倍。在雙液相生物轉(zhuǎn)化中,優(yōu)化的生理?xiàng)l件和過(guò)程控制轉(zhuǎn)化為6倍的生產(chǎn)率比以前報(bào)道的結(jié)果。確定的進(jìn)一步限制包括底物可用性和過(guò)度氧化。可以預(yù)見,類似的參數(shù)限制了許多其他基于CYP2的生物轉(zhuǎn)化的反應(yīng)效率。因此,強(qiáng)烈建議在設(shè)計(jì)全細(xì)胞催化劑時(shí)考慮生理效應(yīng)。
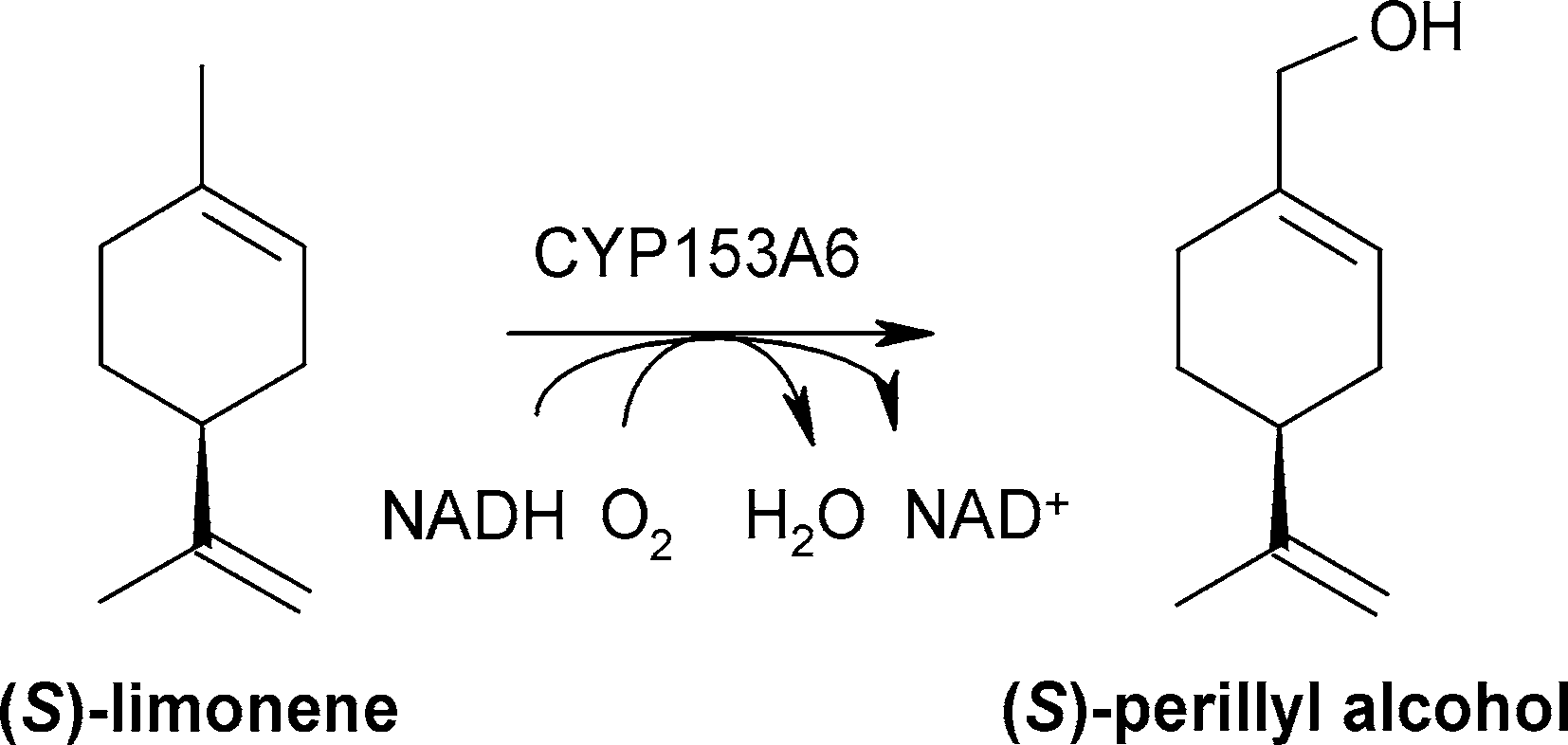
圖4 紫蘇醇的生物轉(zhuǎn)化 [1]
(2)、重組大腸桿菌對(duì)紫蘇醇生產(chǎn)的影響[2]
(R)-(+)-紫蘇醇是一種天然含氧單萜,廣泛用于天然香料添加劑、殺蟲劑、噴氣燃料和抗癌療法。它也是容易獲得的單萜前體。然而,這種天然產(chǎn)物存在于低濃度的植物來(lái)源,這在經(jīng)濟(jì)上是不可行的。因此,微生物生產(chǎn)方法正迅速成為一種有吸引力的替代方法,使(R)-(+)-紫蘇醇生產(chǎn)更加可持續(xù)和環(huán)境友好。[2]
Sun等設(shè)計(jì)了一種外源的甲羥戊酸(MVA)途徑,包括檸檬烯合成酶、對(duì)傘花烴單加氧酶羥化酶和對(duì)傘花烴單加氧酶還原酶,用于生產(chǎn)(R)-(+)-紫蘇醇。從葡萄糖中得到(R)-(+)-紫蘇醇的單萜前體(R)-(+)-檸檬烯的濃度達(dá)到45 mg/L。從而實(shí)現(xiàn)了(R)-(+)-紫蘇醇的增強(qiáng)型生產(chǎn)。該菌株在5l的間歇式生物反應(yīng)器中產(chǎn)生(R)-(+)-紫蘇醇,滴度為87 mg/L,葡萄糖產(chǎn)率為1.5 mg/g。這些數(shù)據(jù)強(qiáng)調(diào)了通過(guò)甲戊酸途徑從葡萄糖高效生產(chǎn)(R)-(+)-紫蘇醇。該方法為今后生產(chǎn)其他單萜類化合物提供了參考依據(jù)。[2]
眾所周知,在(S)-(?)-紫蘇醇生產(chǎn)過(guò)程中,使用大腸桿菌可使滴度提高100 mg/L。許多萜類化合物已經(jīng)通過(guò)代謝工程高效價(jià)生產(chǎn),包括單萜、倍半萜、二萜和四萜。以嗜熱硬脂芽孢桿菌(LHBS)的檸檬烯羥化酶為底物(R)-(+)-檸檬烯可產(chǎn)(R)-(+)-紫蘇醇0.51 mg/L。將LHBS連接到pET28a(+)中創(chuàng)建pSC00,同時(shí)創(chuàng)建pSC01中的cymAa和cymAb。檸檬烯對(duì)大多數(shù)微生物具有毒性,其濃度可以調(diào)節(jié)BL21 (DE3)的生長(zhǎng)。因此,評(píng)價(jià)間歇式生產(chǎn)加料中檸檬烯的最佳濃度是很重要的。不同(R)-(+)-檸檬烯濃度評(píng)估(0.2 mM至3.0 mM)的生長(zhǎng)試驗(yàn)。隨著(R)-(+)-檸檬烯濃度的增加,細(xì)胞生長(zhǎng)受到抑制。在(R)-(+)-檸檬烯濃度為1.0 mM時(shí),SC01的OD600從2.5下降到2.0。當(dāng)(R)-(+)-檸檬烯用量為2 mM時(shí),SC01的最大產(chǎn)量為86.9 mg/L,紫蘇醇的轉(zhuǎn)化率為30%。另一株菌株SC00產(chǎn)生1.5 mg/L的低濃度,細(xì)胞生長(zhǎng)受到抑制。在后續(xù)的研究中,以菌株SC01為研究基礎(chǔ)。產(chǎn)物經(jīng)乙酸乙酯有機(jī)萃取后經(jīng)GC-MS鑒定。對(duì)照試驗(yàn)中大腸桿菌提取物缺乏cDNA克隆,不產(chǎn)生(R)-(+)-紫蘇醇,而攜帶惡臭假單胞菌cymAa和cymAb的大腸桿菌產(chǎn)生的(R)-(+)-紫蘇醇達(dá)到可檢測(cè)量。實(shí)驗(yàn)結(jié)果表明以(R)-(+)-檸檬烯為底物成功構(gòu)建了(R)-(+)-紫蘇醇的生物合成途徑。
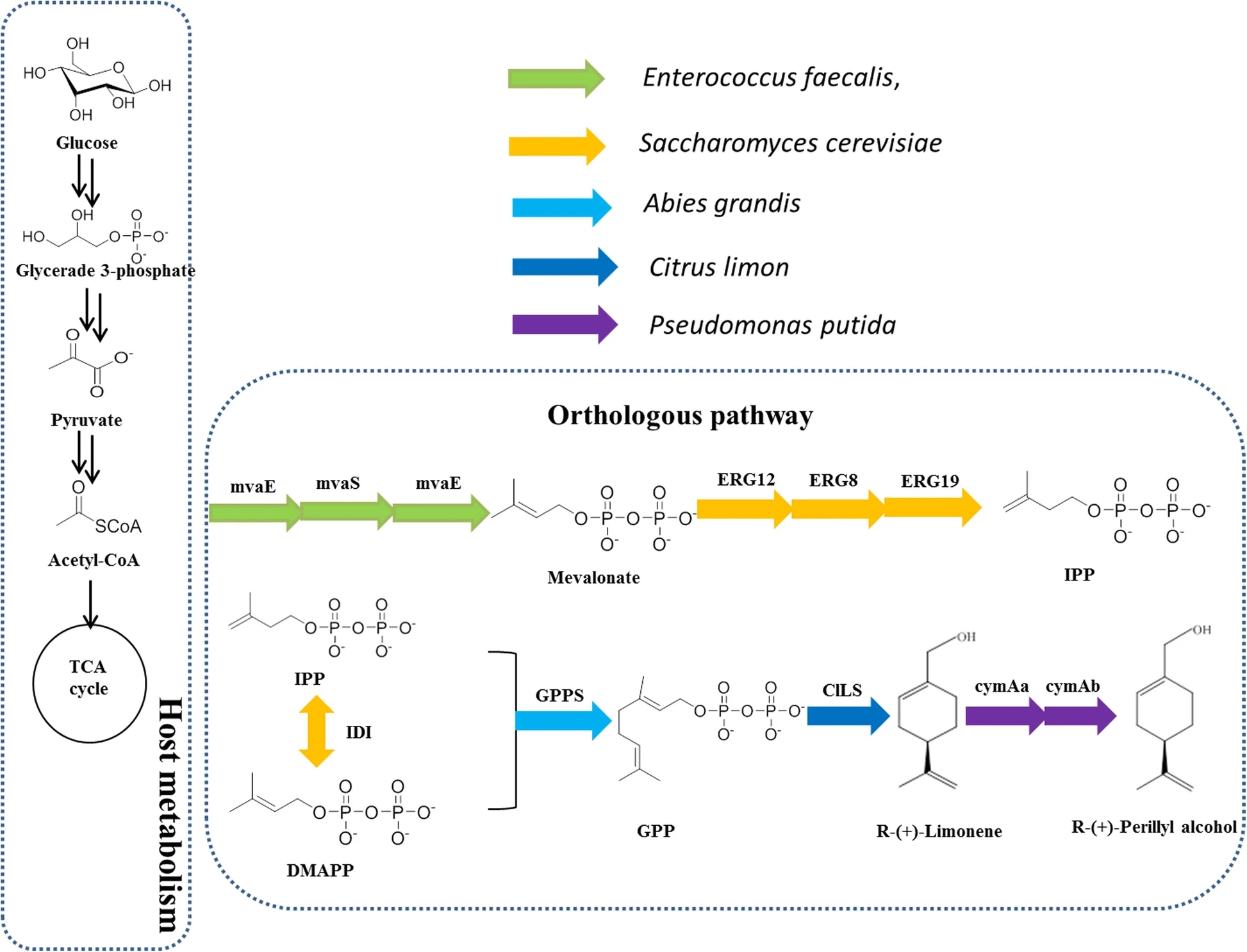
圖5 通過(guò)MVA途徑產(chǎn)生(R)-(+)-紫蘇醇
應(yīng)用領(lǐng)域
1、紫蘇醇作為單體香料,是賦予枯茗香氣、龍涎香氣的化合物,可用于仿制柑橘、香草、水果型的食用香精,食品的賦香劑和醬油的防腐劑。
2、有機(jī)合成重要中間體,紫蘇醇是合成紫蘇醛、紫蘇葶等的關(guān)鍵中間體。
3、合成植物生產(chǎn)調(diào)節(jié)劑、農(nóng)用殺蟲劑和昆蟲拒食劑。
4、紫蘇醇具有獨(dú)特的藥用效果,用于器官移植,可以降低同種異體移植物的排斥作用。
5、紫蘇醇作為一種治療及預(yù)防癌癥的單萜類藥物,具有廣譜、高效、低毒的抗癌作用特點(diǎn),在腫瘤,如卵巢腫瘤、食道癌、乳腺癌等的治療方面有獨(dú)到的治療效果。
生物活性
Perillyl alcohol 是一種單萜醇,從薰衣草,薄荷,櫻桃等植物精油中分離出來(lái)。Perillyl alcohol 可在不影響正常細(xì)胞的情況下誘導(dǎo)腫瘤細(xì)胞凋亡 (apoptosis)。
1、紫蘇醇(單萜醇),檸檬烯
天然產(chǎn)物在傳統(tǒng)藥物中有著悠久的使用歷史,在過(guò)去的幾十年里,它們對(duì)不同疾病的作用一直是許多基礎(chǔ)和臨床研究的焦點(diǎn)。精油是一種含有植物芳香化合物的揮發(fā)性液體,被稱為中草藥中的有效成分。紫蘇醇(Perillyl alcohol, POH)通常可從飲食中獲得,目前正在探索其抗癌化學(xué)預(yù)防、腫瘤生長(zhǎng)抑制和腫瘤消退的作用。柑桔果皮是果汁制造業(yè)的廢棄物,多年來(lái)一直被視為環(huán)境綠色生態(tài)政策的關(guān)鍵問(wèn)題。克服這一問(wèn)題最著名的方法之一是利用特定的細(xì)菌或酵母菌株來(lái)轉(zhuǎn)化這些單萜。檸檬烯(1-甲基-4-異丙基-環(huán)己烯)是一種單萜,因?yàn)槠渌麊屋朴蓛蓚€(gè)異戊二烯單元組成,占柑橘精油的90%以上,存在于許多水果和蔬菜中。盡管d -檸檬烯的抗癌活性早在20年前就已被發(fā)現(xiàn),但它最近在轉(zhuǎn)化醫(yī)學(xué)上引起了更多的關(guān)注。在本章中,我們將概述POH和d -檸檬烯的抗癌作用。稍后,我們將討論這些化合物的藥代動(dòng)力學(xué),重點(diǎn)介紹這些蛋白質(zhì)針對(duì)的信號(hào)通路,回顧在不同癌癥模型中對(duì)這些化合物進(jìn)行的臨床試驗(yàn),最后討論了該領(lǐng)域未來(lái)的研究方向,可能更適用于未來(lái)的癌癥治療策略。
雖然目前還不清楚POH是如何激發(fā)其抗腫瘤作用的,但已經(jīng)報(bào)道了一些潛在的重要機(jī)制。一種可能的機(jī)制是在不影響正常細(xì)胞的情況下,誘導(dǎo)和增強(qiáng)腫瘤細(xì)胞中轉(zhuǎn)化生長(zhǎng)因子-β (TGF-β)信號(hào)轉(zhuǎn)導(dǎo)途徑的表達(dá),進(jìn)而引發(fā)細(xì)胞凋亡,誘導(dǎo)細(xì)胞停滯。然而,其他可能的機(jī)制包括,例如,抑制下游ras信號(hào)通路,調(diào)節(jié)AP-1(激活蛋白-1)的活性,G1早期阻滯,分化,抑制小Rho-GTPase蛋白的異丙烯化,生長(zhǎng)因子的誘導(dǎo),以及調(diào)節(jié)細(xì)胞周期檢查點(diǎn)蛋白的活性(圖6)。

圖6 檸檬烯和紫蘇醇(POH)抗腫瘤作用示意圖。檸檬烯和POH在參與腫瘤進(jìn)展和消退的一些關(guān)鍵途徑中具有多種抑制和刺激作用。這兩種天然產(chǎn)物都在細(xì)胞死亡的調(diào)控中發(fā)揮重要作用。檸檬烯通過(guò)上調(diào)BAX、釋放細(xì)胞色素c、caspase-3、-9、TGF-β和下調(diào)抗凋亡Bcl-2發(fā)揮作用。POH還上調(diào)Bak、caspase-3、FasL、TGF-β、c-fos和c-Jun,并阻斷ERK1/2磷酸化和Mek-Erk通路。檸檬烯和POH都可以通過(guò)下調(diào)癌細(xì)胞中VEGF的基礎(chǔ)生成來(lái)抑制腫瘤進(jìn)展。它們還能抑制甲戊酸途徑以及小G蛋白的異戊烯化,導(dǎo)致腫瘤消退。
POH可通過(guò)抑制甲戊酸途徑發(fā)揮膽固醇生物合成的調(diào)節(jié)作用。根據(jù)對(duì)膽固醇生物合成的影響,有報(bào)道稱,在一項(xiàng)研究中觀察到,服用POH的老鼠體重下降了近10%,這是由于體脂減少。先前的研究也表明,POH能夠通過(guò)阻斷3-羥基-3-甲基戊二酰輔酶A向甲戊酸的轉(zhuǎn)化,進(jìn)而抑制小Rho-GTPase蛋白和3-羥基-3-甲基戊二酰輔酶A還原酶的合成來(lái)影響甲戊酸途徑,導(dǎo)致異戊烯化Ras和Ras相關(guān)蛋白的活性降低。因此,它被認(rèn)為是一種戊烯基轉(zhuǎn)移酶抑制劑。法尼酰基化是Ras基因突變體活性所必需的,而法尼酰基轉(zhuǎn)移酶(FTase)抑制劑可阻斷Ras基因的致癌活性。然而,一個(gè)有趣的說(shuō)法是,這種單萜可以以一種不依賴Ras的方式對(duì)白血病細(xì)胞產(chǎn)生抗癌作用。這一發(fā)現(xiàn)支持了一種觀點(diǎn),即在Ras依賴和Ras獨(dú)立途徑中,存在其他可能的機(jī)制導(dǎo)致其對(duì)不同類型的惡性細(xì)胞的癌癥化學(xué)預(yù)防作用。在不影響正常對(duì)照的情況下,Bcl-2同源拮抗劑/殺手(BAK)在腫瘤中誘導(dǎo)凋亡(一種促凋亡蛋白),證實(shí)POH對(duì)胰腺癌的增殖抑制作用。POH作用于肝臟腫瘤的機(jī)制是通過(guò)刺激TGF-β和M6P/IGF II(甘露糖-6-磷酸/胰島素樣生長(zhǎng)因子-II)受體,增加腫瘤細(xì)胞的損失率。抑制絲裂原/細(xì)胞外信號(hào)調(diào)節(jié)激酶(Mek) -細(xì)胞外信號(hào)調(diào)節(jié)激酶(Erk)通路被認(rèn)為是POH的另一作用機(jī)制。與這一觀點(diǎn)一致的是,另一項(xiàng)研究報(bào)道POH通過(guò)阻斷K562細(xì)胞中的ERK1/2磷酸化和小GTPase信號(hào)通路,在誘導(dǎo)細(xì)胞凋亡中發(fā)揮關(guān)鍵作用。這些結(jié)果表明,POH可能有幾個(gè)靶點(diǎn),當(dāng)被該途徑激活時(shí),可能是關(guān)鍵的癌癥治療。POH還可以下調(diào)癌細(xì)胞中血管內(nèi)皮生長(zhǎng)因子(VEGF)的基礎(chǔ)生成,上調(diào)內(nèi)皮細(xì)胞中血管生成素-2的釋放,導(dǎo)致腫瘤消退。POH的靶向途徑見圖6。
一項(xiàng)研究表明,在膠質(zhì)瘤細(xì)胞中,POH通過(guò)增加Fas配體的表達(dá)來(lái)發(fā)揮其作用,從而增強(qiáng)化療的傳遞和療效。POH的化學(xué)預(yù)防作用通過(guò)抑制UVB誘導(dǎo)的AP-1活化在體內(nèi)外皮膚腫瘤的促進(jìn)作用得到證實(shí)。這一發(fā)現(xiàn)與在人乳腺腫瘤細(xì)胞株T47D-C4-2W中的研究結(jié)果不一致,該研究表明poh通過(guò)c-Jun n端激酶/應(yīng)力激活蛋白激酶途徑誘導(dǎo)c-fos和c-Jun(兩個(gè)相互結(jié)合形成AP-1的癌蛋白)的轉(zhuǎn)錄活性,并隨后激活A(yù)P-1。另一項(xiàng)臨床前研究證實(shí)POH在乳腺癌中通過(guò)改變c-Jun和c-fos的功能,并誘導(dǎo)BAX和bad等促凋亡基因表達(dá),參與TGF-β下游基因表達(dá)的激活和AP-1的誘導(dǎo)。c-Jun和c-fos在細(xì)胞凋亡前和凋亡過(guò)程中均被激活,POH的刺激可能是導(dǎo)致細(xì)胞死亡的信號(hào)級(jí)聯(lián)的早期關(guān)鍵事件。POH對(duì)雄激素受體(AR)基因表達(dá)的抑制和對(duì)c-Jun表達(dá)的刺激可減弱AR介導(dǎo)的雄激素反應(yīng)性前列腺細(xì)胞的作用。POH也被證明參與抑制人類乳腺癌細(xì)胞株的細(xì)胞生長(zhǎng)、細(xì)胞周期進(jìn)展和cyclin D1基因表達(dá)。其他體外研究報(bào)道了POH對(duì)胰腺癌和肺癌細(xì)胞[52]生長(zhǎng)的抑制作用。研究證實(shí),細(xì)胞周期蛋白D1和E的降低、p21 (Cip1/Waf1)的增強(qiáng)和PCNA表達(dá)的降低有助于在培養(yǎng)的人乳腺癌細(xì)胞中實(shí)現(xiàn)細(xì)胞周期阻滯。這是POH在裸鼠系統(tǒng)中抗人乳腺癌細(xì)胞增殖和轉(zhuǎn)移的作用機(jī)制。Balassiano等研究了POH對(duì)膠質(zhì)細(xì)胞C6細(xì)胞系和雞胚絨毛膜模型的影響,發(fā)現(xiàn)POH在體外和體內(nèi)均發(fā)揮了抗轉(zhuǎn)移分子的作用。體外實(shí)驗(yàn)表明,POH通過(guò)破壞細(xì)胞骨架機(jī)制來(lái)抑制乳腺細(xì)胞的遷移,而不影響細(xì)胞黏附。體外研究表明,POH在神經(jīng)母細(xì)胞瘤衍生的神經(jīng)- 2a細(xì)胞中起誘導(dǎo)分化作用。將這些細(xì)胞與POH孵育后,發(fā)現(xiàn)它抑制了DNA合成。對(duì)POH誘導(dǎo)腫瘤生長(zhǎng)衰退部位的組織學(xué)觀察表明,POH與腫瘤細(xì)胞的再分化有關(guān)。最近,人們提出了另一種POH抑制前列腺癌進(jìn)展的機(jī)制,該機(jī)制可以通過(guò)獨(dú)特的協(xié)同降低hTERT(人端粒酶逆轉(zhuǎn)錄酶)蛋白翻譯和破壞hTERT - mtor(雷帕霉素的機(jī)制靶點(diǎn))-RAPTOR蛋白復(fù)合物來(lái)調(diào)節(jié)端粒酶活性。結(jié)果證實(shí)了致瘤性休克的假說(shuō)。他們發(fā)現(xiàn)POH對(duì)端粒酶和TERT蛋白的調(diào)節(jié)與eIF4E(真核翻譯起始因子4E)水平高相關(guān),而對(duì)eIF4E水平低的正常pMV7細(xì)胞則無(wú)影響。POH的作用機(jī)理概述如圖6所示。
2、單萜紫蘇醇:抗癌劑和克服生物屏障的介質(zhì)
紫蘇醇(POH)是一種與檸檬烯有關(guān)的天然單萜,存在于各種植物的精油中。它有多種用途,可以在家庭用品中找到,包括食品、化妝品和清潔用品。在過(guò)去的三十年里,人們也對(duì)其潛在的抗癌活性進(jìn)行了研究。盡管鼻腔內(nèi)POH制劑在惡性膠質(zhì)瘤患者中產(chǎn)生了令人鼓舞的結(jié)果,但在癌癥患者中使用口服POH制劑的臨床試驗(yàn)未能實(shí)現(xiàn)預(yù)期的治療效果。基于它的兩性特性,POH顯示了克服生物屏障的能力,主要是血腦屏障(BBB),但也有細(xì)胞質(zhì)膜和皮膚,這似乎是POH在藥物開發(fā)和傳遞方面的重要貢獻(xiàn)。在這篇綜述中,我們介紹了POH的物理化學(xué)性質(zhì),這是它能夠克服不同類型生物屏障所帶來(lái)的障礙的基礎(chǔ),從而塑造了它在癌癥治療和藥物開發(fā)中的多方面前景。我們總結(jié)和評(píng)價(jià)了大量的臨床前和臨床研究,這些研究探討了POH在鼻內(nèi)給藥和鼻到腦的藥物運(yùn)輸、其動(dòng)脈內(nèi)給藥用于血腦屏障打開以及其在雜化分子中的滲透增強(qiáng)功能,POH與其他治療藥物結(jié)合或偶聯(lián),產(chǎn)生具有新的作用機(jī)制和應(yīng)用的新的化學(xué)實(shí)體。[4]
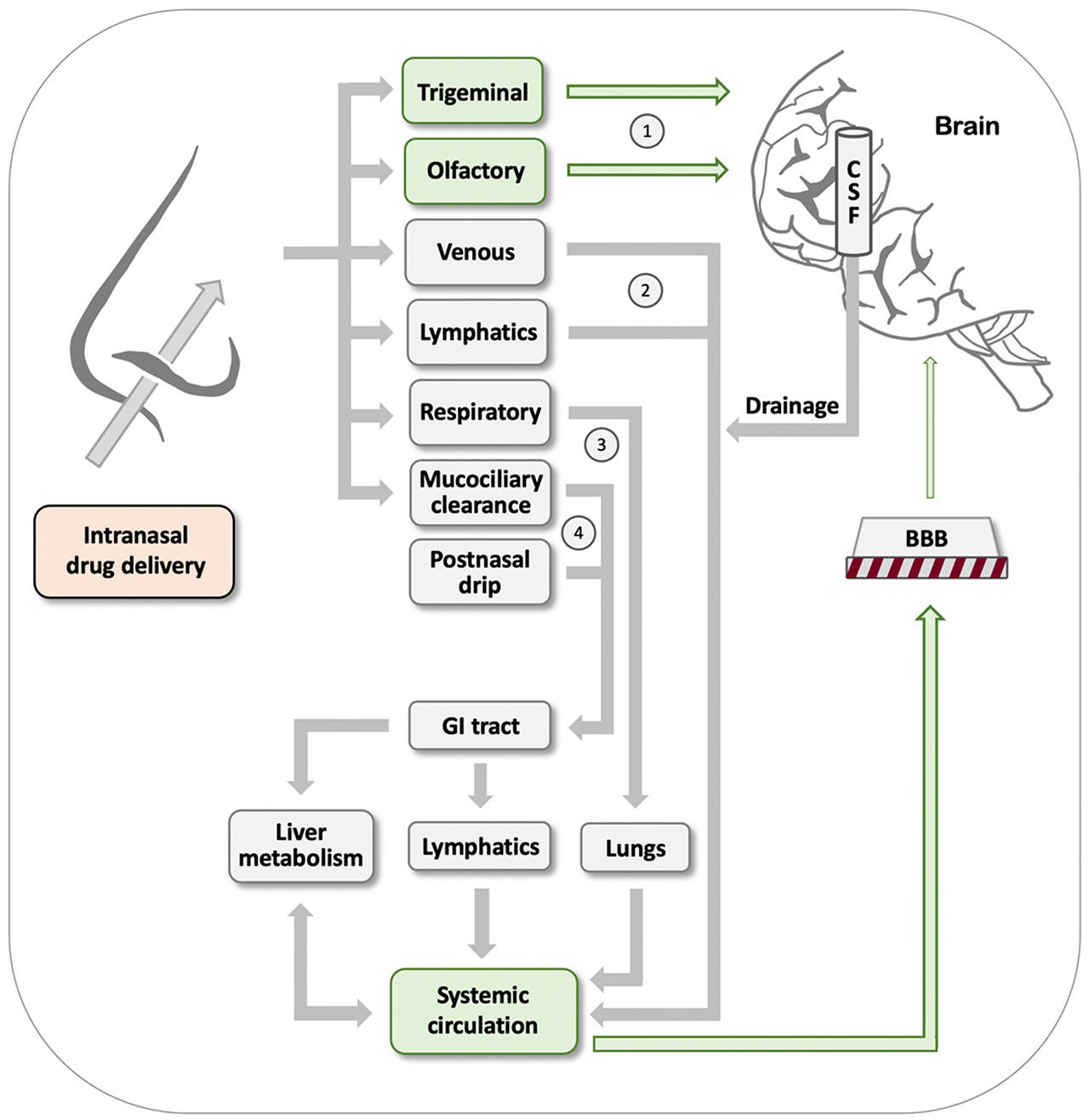
圖7 可用于鼻內(nèi)給藥的途徑。經(jīng)鼻給藥后,藥物可能通過(guò)幾種截然不同的途徑到達(dá)大腦:通過(guò)三叉神經(jīng)和嗅覺神經(jīng)(標(biāo)記為1)直接從鼻子到大腦的運(yùn)輸,或通過(guò)標(biāo)記為2-4的機(jī)制首次進(jìn)入血液的間接運(yùn)輸。然而,在后一種途徑中,藥物會(huì)遇到血腦屏障,這阻止了絕大多數(shù)藥物制劑有效地進(jìn)入大腦。詳情請(qǐng)參閱文本。[4]
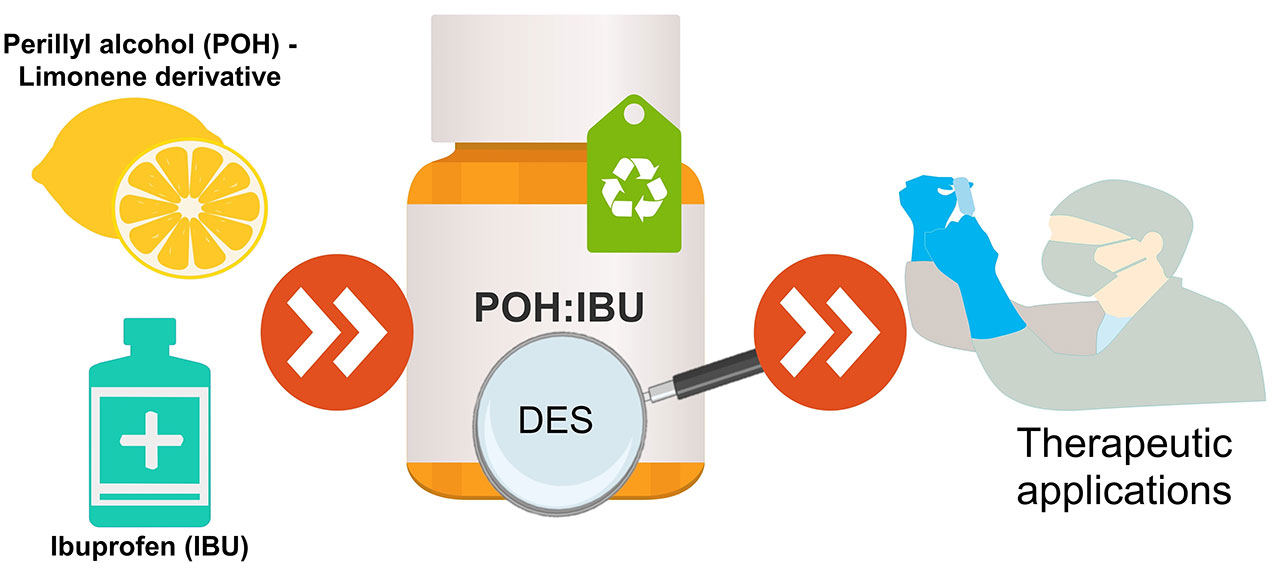
3、紫蘇醇和布洛芬基底物的優(yōu)化設(shè)計(jì)
治療性深共晶體系(THEDES)由于能夠提高活性藥物成分(APIs)的生物利用度,在制藥領(lǐng)域得到了廣泛的應(yīng)用。然而,它們的生物學(xué)性能還沒(méi)有被仔細(xì)研究過(guò)。以紫蘇醇(POH)和布洛芬(IBU)為原料,采用不同的摩爾比制備了二乙基醚。我們的綜合策略包括表征它們的熱和結(jié)構(gòu)行為,以確定成功形成深共晶體系的摩爾比。制備的不同體系的體外溶解度表明,與其他報(bào)道的例子不同,萜烯的存在并不影響抗炎劑在生理模擬介質(zhì)中的溶解度。該系統(tǒng)的生物性能是研究他們的抗菌活性對(duì)廣泛的微生物菌群。除銅綠假單胞菌外,THEDES對(duì)所有供試菌株均有抗菌活性。驗(yàn)證了POH和IBU作為共晶體系的結(jié)合具有協(xié)同效應(yīng)。此外,在體外細(xì)胞模型中,也評(píng)估了這些共晶系統(tǒng)對(duì)結(jié)直腸癌(CRC)的細(xì)胞毒性。結(jié)果表明,細(xì)胞活力以劑量依賴性的方式變化,有選擇性的THEDES作用于CRC細(xì)胞。隨著可調(diào)節(jié)的生物活性在一個(gè)比例依賴的方式,THEDES增強(qiáng)了抗菌和抗癌的特性,代表了一個(gè)可能的替代傳統(tǒng)療法。因此,本研究為基于POH和IBU的THEDES作為新型活性藥物系統(tǒng)的強(qiáng)大候選藥物的應(yīng)用提供了可預(yù)見的方向。[5]
4、不同載體中紫蘇醇的釋放
背景:皮膚癌是人類最常見的惡性腫瘤,在過(guò)去的幾十年里,皮膚癌的病例數(shù)量急劇增加。因此,開展新的和更安全的抗癌天然藥物(如紫蘇醇)和現(xiàn)代藥物傳遞系統(tǒng)(如納米制劑)的研究,以提高其生物利用度是非常重要的。
目的:研究不同劑型紫蘇醇的體外緩釋作用,并比較其緩釋效果。利用選定的數(shù)學(xué)模型確定了釋放動(dòng)力學(xué)。
方法:采用水凝膠、O/W納米乳液、O/W大乳液和納米脂質(zhì)載體作為紫蘇醇的載體。使用Spectra/Por標(biāo)準(zhǔn)再生纖維素膜,在溫度T=32℃下進(jìn)行活性成分的釋放研究。用高效液相色譜法分析了受體溶液中活性藥物的濃度。利用選定的數(shù)學(xué)模型確定了釋放動(dòng)力學(xué)。
結(jié)果:紫蘇醇的釋放量分別為水凝膠(35.72±0.21%)、NLC(35.54±1.48%)和納米乳(34.87±4.49%)。在水凝膠和大乳狀液中,其釋放遵循fick擴(kuò)散規(guī)律,而在納米制劑中則表現(xiàn)出一種反常的機(jī)制。然而,獲得的納米制劑以及常規(guī)水凝膠可被認(rèn)為是紫蘇醇局部給藥的潛在載體。[6]
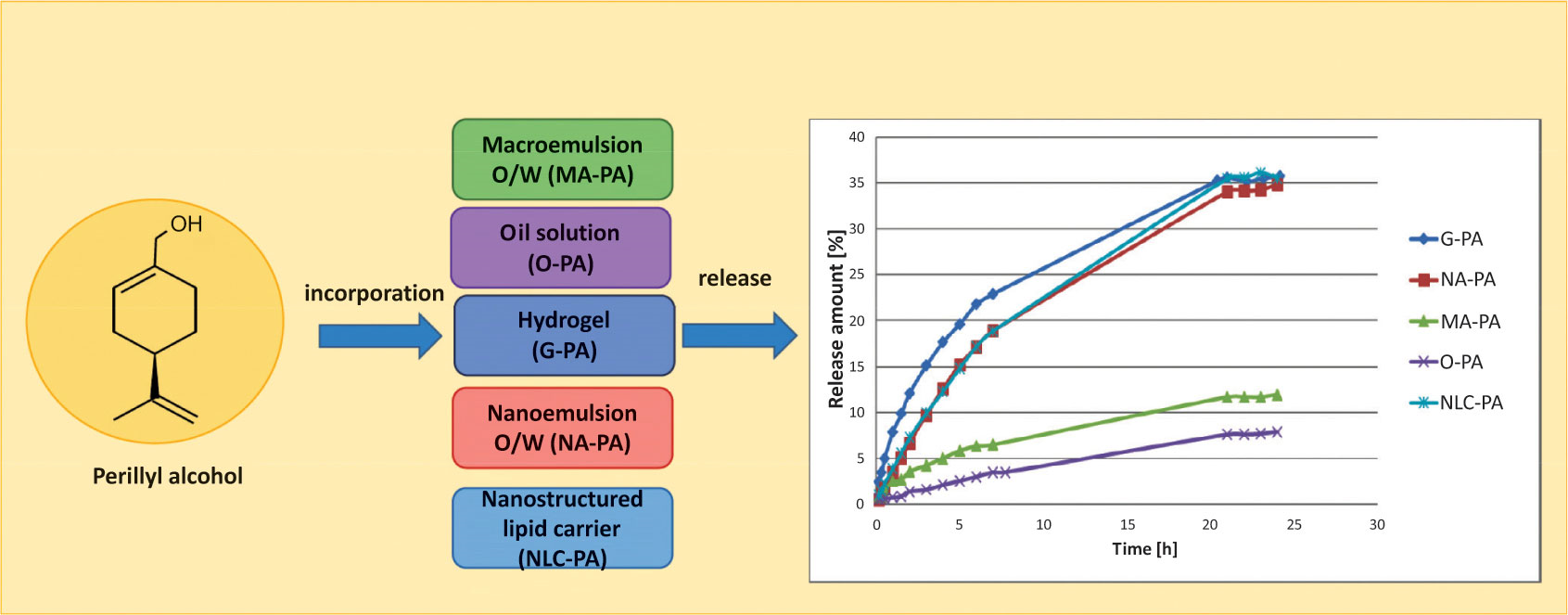
圖8 不同載體中紫蘇醇的釋放動(dòng)力學(xué)曲線[6]
參考文獻(xiàn)
[1] Cornelissen, Sjef & Liu, Shanshan & Deshmukh, Amit & Schmid, Andreas & Bühler, Bruno. (2011). Cell physiology rather than enzyme kinetics can determine the efficiency of cytochrome P450-catalyzed C-H-oxyfunctionalization. Journal of industrial microbiology & biotechnology. 38. 1359-70. 10.1007/s10295-010-0919-y.
[2] Sun, C., Dong, X., Zhang, R. et al. Effectiveness of recombinant Escherichia coli on the production of (R)-(+)-perillyl alcohol. BMC Biotechnol 21, 3 (2021). https://doi.org/10.1186/s12896-020-00662-7
[3] Shojaei, Shahla & Kiumarsi, Amir & Rezaei Moghadam, Adel & Alizadeh, Javad & Marzban, Hassan & Ghavami, Saeid. (2014). Perillyl Alcohol (Monoterpene Alcohol), Limonene. 10.1016/B978-0-12-802215-3.00002-1.
[4] Chen TC, da Fonseca CO, Levin D, Sch?nthal AH. The Monoterpenoid Perillyl Alcohol: Anticancer Agent and Medium to Overcome Biological Barriers. Pharmaceutics. 2021; 13(12):2167. https://doi.org/10.3390/pharmaceutics13122167
[5] Silva E, Oliveira F, Silva JM, Matias A, Reis RL, Duarte ARC. Optimal Design of THEDES Based on Perillyl Alcohol and Ibuprofen. Pharmaceutics. 2020; 12(11):1121. doi. 10.3390 / pharmaceutics 12111121
[6]Miastkowska Malgorzata *, Konieczna Monika , Lason Elwira , Tabaszewska Malgorzata , Sikora Elzbieta and Ogonowski Jan, The Release of Perillyl Alcohol from the Different Kind of Vehicles, Current Pharmaceutical Biotechnology 2018; 19(7) .doi.org/10.2174/1389201019666180730165330