服務熱線
177-5061-9273

紫羅蘭酮-又稱香堇酮,屬于玫瑰酮類化合物家族的一分子,是從類胡蘿卜素降解得來。有α,β,γ三種異構物,但只有α、β才是天然的,多半同時存在于紫羅蘭、桂花、鳶尾草精油中,γ為人工合成物質。紫羅蘭酮是單獨聞并不特別香的成分,但是只要和其他芳香分子混合后,優雅的紫羅蘭花香就會迸發出來。
| 中文名稱 | α-紫羅蘭酮 | β-紫羅蘭酮 | 鳶尾草酮,又稱甲基-紫羅蘭酮 |
| 英文名稱 | α-Ionone | β-Ionone | Irone |
| 精油來源 | 桂花(β為主)、鳶尾草、紫羅蘭、紅花緬梔、穗甘松、云木香 | ||
| 氣味描述 | 甜膩莓果香、近似覆盆子果醬,有很強大的氣味沖擊性 | 有點像桂花、雪松那樣幽微、隱喻的氣味 | 紫羅蘭、鳶尾花的干燥氣味,帶有一點甜 |
| 芳療功效 | 1.穿透性強,可以游走在免疫細胞附近,直接抑制癌細胞擴散、抗癌效果強大但機制不明,以β-紫羅蘭酮為翹楚;2.溫和的化痰、去除擁塞感,適合年幼體虛者在呼吸不順、感冒時使用 | ||
| 心靈功效 | 強大的保護與修復力,化解心中煩悶 | 治愈人的抑郁與憂傷 | 使人心情舒暢,精神爽朗 |
紫羅蘭酮是一種由13個碳組成的酮類化合物,具有一個單環萜類骨架。ionone這個術語來源于“iona”(希臘語中紫羅蘭的意思),指的是紫羅蘭的氣味,而“酮”則與它的結構有關。
在自然界中存在多種異構體,包括α-紫羅蘭酮、β-紫羅蘭酮等。紫羅蘭酮是植物的次生代謝產物,與甲戊酸有共同的前體。它們廣泛存在于含有β-胡蘿卜素的水果和蔬菜中,并在植物精油中被發現,例如矮牽牛(Petunia hybrida)、波羅尼花(Boronia megastigma Nees)和尤其是香堇菜(Viola odorata)的精油中。它存在于牛乳中,是牛在食用苜蓿牧草后被動轉移所至。
α-紫羅蘭酮和β-紫羅蘭酮分別被2,6,6-三甲基-2-環己烯-1-基和2,6,6-三甲基-1-環己烯-1-基取代的3-丁烯-2-酮。紫羅蘭酮立體異構體α-紫羅蘭酮和β-紫羅蘭酮是淡黃色到黃色的液體,具有木香花香。然而,前者有額外的蜂蜜氣味方面。α-紫羅蘭酮和β-紫羅蘭酮具有相似的理化性質。它們均可溶于大多數固定油、醇和丙二醇,但不溶于或極微溶于甘油/水。
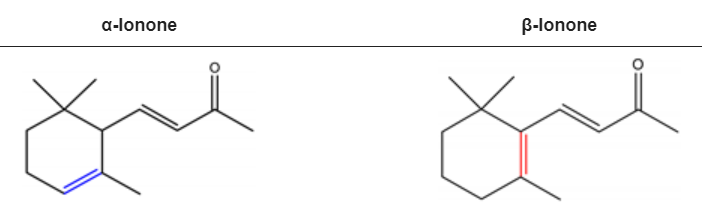
α-紫羅蘭酮和β-紫羅蘭酮的化學結構
α-紫羅蘭酮和β-紫羅蘭酮都被廣泛用于各種行業的芳香成分,包括化妝品(如洗發水、肥皂)和非化妝品(如家用洗滌劑和清潔劑)產品。香精和提取物制造商協會(FEMA)宣布,當用作調味劑時,這兩種紫羅蘭酮通常被認為是安全的(GRAS)。美國食品藥品監督管理局也批準了它們作為調味劑的使用。
紫羅蘭酮的維基百科
紫羅蘭酮(Ionone),又稱香堇酮,是一種萜類物質,根據雙鍵位置不同有三種異構體。香堇酮的詞源是希臘語?ον(íon),意思是香堇菜。中文常將香堇菜誤譯為紫羅蘭,兩者實為不同物種。
紫羅蘭酮屬于玫瑰酮,存在于包括玫瑰精油的多種花精油中。β-紫羅蘭酮是玫瑰香氣的主要貢獻物,雖然其在精油中含量相對較低。紫羅蘭酮是一個重要的香料化學品,用于香水,香料和調味料。[1]紫羅蘭酮在生物中來源于類胡蘿卜素的降解。
胡蘿卜素包括α-胡蘿卜素,β-胡蘿卜素,γ-胡蘿卜素,葉黃素和β-隱黃質,都含有β-紫羅蘭酮結構,具有維生素A的活性,它們在動物體內可轉化成視黃醇。無β-紫羅蘭酮結構的類胡蘿卜素則不能被轉換為視黃醇,沒有維生素A活性。
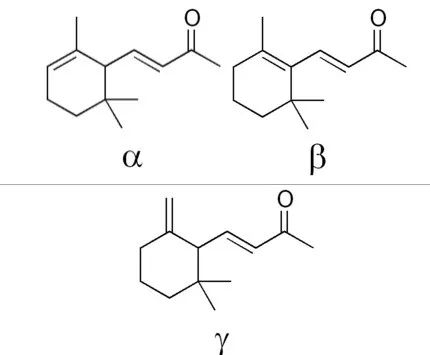
IUPAC名:α: (3E)-4-(2,6,6-Trimethylcyclohex-2-en-1-yl)but-3-en-2-one
β: (3E)-4-(2,6,6-Trimethylcyclohex-1-en-1-yl)but-3-en-2-one
γ: (3E)-4-(2,2-Dimethyl-6-methylenecyclohexyl)but-3-en-2-one
別名:Cyclocitrylideneacetone, irisone, jonon
CAS號:79-76-5 ;α: 127-41-3;β: 79-77-6;γ: 79-76-5
化學式:C13H20O
分子量:192.30 g/mol
密度:α: 0.933 g/cm3;β: 0.945 g/cm3
熔點:β: ?49 °C
沸點:β: 126–128 °C at 12 mmHg
紫羅蘭酮的化學合成
從植物精油提取的方法得到的量微且昂貴,紫羅蘭酮主要通過化學合成。
檸檬醛和丙酮在氧化鈣催化下縮合得假性紫羅蘭酮(pseudoionone):[2][3]
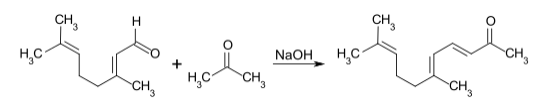
機理如下,是一個典型的羥醛縮合反應:
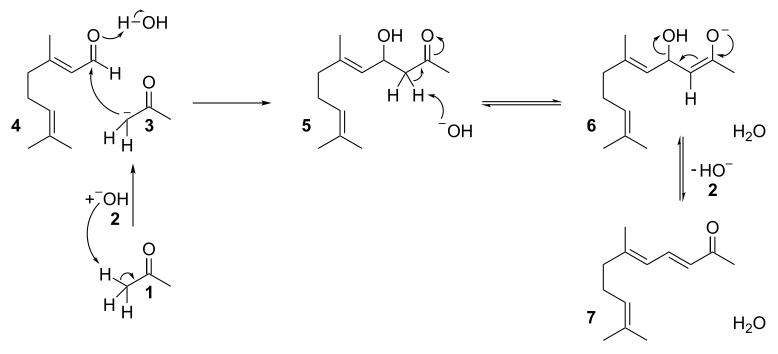
再由酸催化關環,發生碳正離子重排,得香堇酮的各種異構體。機理如下:
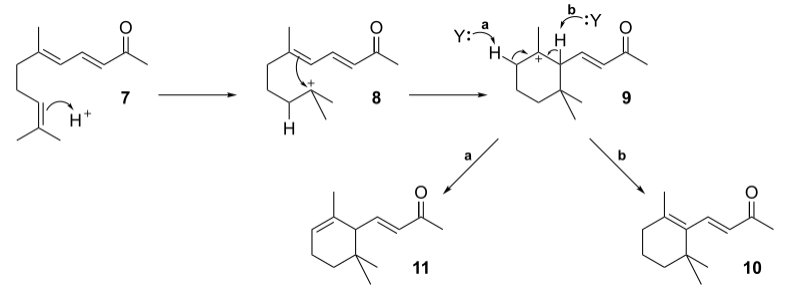
磷酸催化主要得α-異構體,硫酸催化主要得β-異構體,三氟化硼催化主要得γ-異構體。
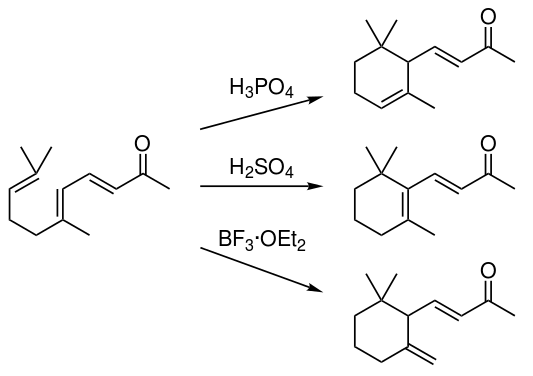
空氣中微量香堇酮就能被嗅覺捕獲。α-香堇酮的閾值為3ppb(3×10?7mg/L),β-香堇酮位0.12ppb、(R)-γ-香堇酮為11ppb、(S)-γ-香堇酮為0.07ppb。[4]
紫羅蘭酮的內源性合成
β-胡蘿卜素氧合酶1(BCO1)
類胡蘿卜素是水果和蔬菜中天然存在的化合物。它們是一類具有長共軛雙鍵鏈結構的異戊二烯類化合物。在人體中,天然發現的主要類胡蘿卜素是α-胡蘿卜素、β-胡蘿卜素、β-隱黃質、番茄紅素和葉黃素。β-胡蘿卜素在中央15,15 '雙鍵處的氧化裂解產生兩個全反式視黃醛對映異構體。然后,全反式視黃醛分別被氧化為全反式視黃酸或還原為全反式視黃醇(維生素A)。這一過程由胞漿酶β-胡蘿卜素氧合酶1 (BCO1)完成,也被鑒定為β-胡蘿卜素-15,15 ' -單氧合酶1 (BCMO1)。綜上所述,類胡蘿卜素要轉化為維生素A,必須至少含有一個非取代的β-紫羅蘭酮環,因此BCO1只能促進β-隱黃質、α-胡蘿卜素和β-胡蘿卜素的裂解。
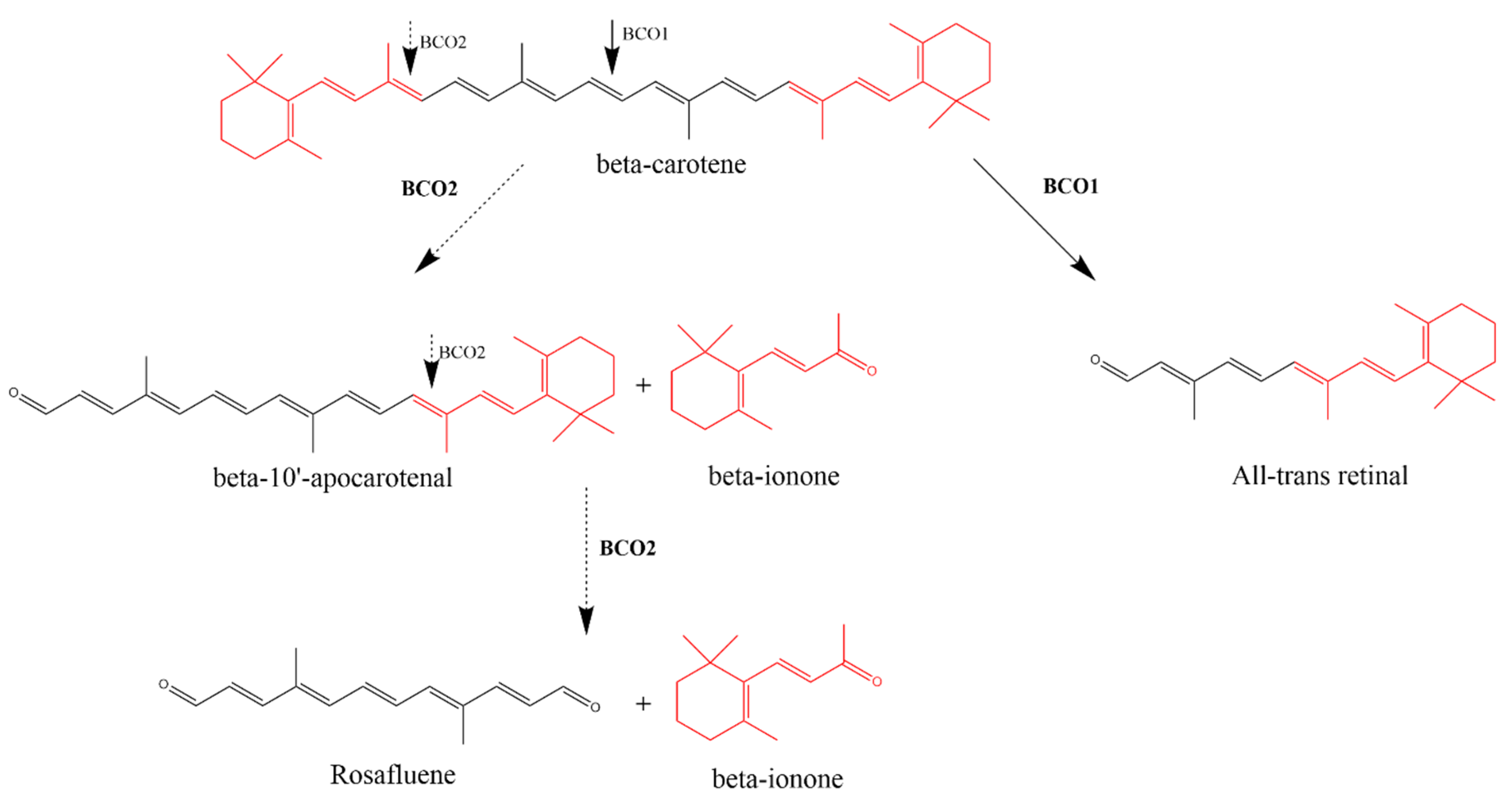
β-胡蘿卜素氧合酶1 (BCO1)和β-胡蘿卜素氧合酶2 (BCO2)對β-胡蘿卜素的酶解作用。BCO1催化β-胡蘿卜素在15,15 '雙鍵的中心裂解,形成兩個全反式視網醛對映異構體分子。β-胡蘿卜素9,10雙鍵的不對稱裂解在BCO2的催化下產生了β-紫羅蘭酮和β-10 ' -阿樸胡蘿卜素醛(apocarotenal)。在9 ',10 '雙鍵上的另一次裂解產生了另外的β-紫羅蘭酮部分和薔薇烯。
β-胡蘿卜素氧合酶2 (BCO2)介導合成
德國弗萊堡大學的Vogt和von Lintig首次描述了紫羅蘭酮的內源性合成,這種合成是通過酶介導的β-胡蘿卜素的不對稱裂解實現的。然而,美國凱斯西儲大學的von Lintig對這種酶進行了進一步的研究。β-紫羅蘭酮和β-apo-10 ' -胡蘿卜素是β-胡蘿卜素不對稱裂解的產物。這種在9 ',10 '雙鍵的裂解是由β-胡蘿卜素氧合酶2 (BCO2)促進的,也被稱為β-胡蘿卜素-9 ',10 ' -雙氧合酶2 (BCDO2)。另一個在9 ',10 '雙鍵處的裂解產生額外的β-紫羅蘭酮部分和薔薇烯,薔薇烯是一種自然存在于玫瑰中的化合物。BCO2和BCO2酶之間的差異并不局限于它們的拆分機制。BCO2可以不對稱地拆分含有羥基化紫羅蘭酮和非環類胡蘿卜素(包括非維生素原A類胡蘿卜素)的類胡蘿卜素,如番茄紅素和葉黃素,因此具有更廣泛的底物特異性。此外,BCO2定位于線粒體內膜,而BCO1是胞質蛋白。BCO1和BCO2之間的這些差異表明了BCO2獨特的生理作用。
β-胡蘿卜素的中心裂解(通過BCO1)是類視黃醇(retinoid)生成的主要途徑。同時,β-胡蘿卜素的不對稱裂解(通過BCO2)是類視黃醇(retinoid)生成的補充途徑。后來有報道稱BCO1基因敲除的小鼠重組BCO2后,具有維生素A缺乏癥。此外,前列腺和子宮內膜結締組織、內分泌胰腺、心臟和骨骼肌中只表達BCO2,不表達BCO1。值得注意的是,其中一些組織對維生素A缺乏并不敏感,因此BCO2被認為是獨立于維生素A合成發揮生理作用的;這表明β-紫羅蘭酮(BCO2的產物之一)可能參與了其他潛在的生物功能。BCO2可能對肝脂肪變性起到一定的預防作用。BCO2缺乏/突變導致各種動物脂肪組織和小鼠模型線粒體中類胡蘿卜素的積累。類胡蘿卜素反過來又會引起氧化應激,從而導致細胞凋亡。因此,BCO2可以保護細胞免受類胡蘿卜素誘導的氧化應激帶來的凋亡。β-紫羅蘭酮水平與BCO2突變之間的關系尚未被研究。BCO2的突變或缺失可能導致β-紫羅蘭酮水平的降低,并可能導致上述疾病的發病機制。此外,β-紫羅蘭酮內源性合成的發現表明,β-紫羅蘭酮可能具有尚未揭示的生理作用。統計學數據表明,大量攝入含有揮發性異戊二烯類物質的水果和蔬菜,可以降低患癌癥的風險。目前的研究主要集中在BCO2和β-紫羅蘭酮產生的原胡蘿卜素(apocarotenoids)的生物學作用,而對β-紫羅蘭酮的研究較少。
由蒎烯合成紫羅蘭酮的可能性
松節油的主要成分是蒎烯。從松樹油脂中提取的松節油被廣泛應用于醫藥和葡萄酒中作為防腐劑和增味劑。人們注意到,食用松節油會使尿液的氣味帶有紫羅蘭香。據傳,埃及艷后克利奧帕特拉曾用松節油來達到這個目的。然而,將松節油與尿液混合并不能使尿液散發出紫羅蘭般的氣味。人們認為紫羅蘭酮是產生紫羅蘭氣味的化合物。因此,松節油中最常見的化合物蒎烯應該轉化為紫羅蘭酮,然后紫羅蘭酮必須從腎臟排出,以產生尿液中的紫羅蘭氣味。肝酶(細胞色素P450)可能參與了蒎烯向紫羅蘭酮的轉化。
Al-Tel和他的同事提出了α和β-蒎烯轉化為α和β-ionone的可能代謝途徑(下圖)。首先,CYP酶會氧化α和β-蒎烯生成中間產物(1)和(a)。β-蒎烯(a)生成的中間體經過自由基重排生成中間體(b)。β-蒎烯(a)生成的中間體(b)從CYP中得到一個氫自由基生成中間體(c)。

然后CYP從中間體(c)中提取氫自由基。至此,可以假設這兩條途徑通過中間體1的形成而相遇。隨后自由基重排和環丁基環的裂解應該產生中間體2。后者氧化成醇3,再氧化成醛4。中間體4與丙酮發生克腦文蓋爾縮合反應(Knoevenagel,指含有活潑亞甲基的化合物與醛或酮在弱堿催化下,發生失水縮合生成α,β-不飽和羰基化合物及其類似物)生成5。中間體5的sigma重排會生成中間體6。后者可以重新排列形成中間產物7,中間產物7又可以重新排列形成α-或β-紫羅蘭酮。在這一推測的蒎烯向紫羅蘭酮的代謝轉化中,丙酮是一個關鍵的角色。它可以在生物體內通過乙酰乙酸脫羧或2-丙醇脫氫生成。前者是哺乳動物中丙酮的主要來源。所提出的催化反應是由計算的物理化學性質支持的。α-和β-紫羅蘭酮的親水性高于α-和β-蒎烯,表明蒎烯轉化為紫羅蘭酮有利于腎臟排泄。通過CYP亞型預測的蒎烯代謝位點為:1A2、3A4、2C19和2D6。
嗅覺受體
嗅覺受體(OR)是檢測揮發性物質的G蛋白偶聯受體。在嗅覺神經元中,OR與Golf(類似于Gαs的G蛋白)結合后激活腺苷酸環化酶并產生cAMP,從而導致細胞內鈣離子的增加。1992年,Parmentier和他的同事在哺乳動物生殖細胞中發現了第一個OR基因轉錄本。進一步的研究表明,OR的表達并不局限于嗅上皮,但它們在迄今研究的所有人體組織中都有表達,如結腸、肺、卵巢、肝臟、腎臟、淋巴結、心臟、血液、睪丸、骨骼肌、皮膚、脂肪、腎上腺、大腦、乳房、前列腺和甲狀腺。已經鑒定出40多種不同的OR,它們被發現在多于45種不同的人體組織中表達。OR的這種異位表達表明OR的功能不僅僅是氣味的檢測和辨別。有研究報道了異位表達OR的各種功能,如調節腸嗜鉻細胞的血清素釋放、癌細胞增殖、胞質分裂、血壓、腎臟的酶分泌和精子的趨化。
幾項研究表明,紫羅蘭酮與OR51E2結合。OR51E2本質上是屬于OR家族51和E亞家族的紫羅蘭酮受體,它的成員2在哪里?OR51E2不僅是mRNA水平上表達最多的ORs之一;它存在于許多組織中。OR51E2在前列腺組織(3-∞FPKM)中含量最高,而在肝臟(0-0.01 FPKM)、大腦(0.01-0.1 FPKM)、睪丸(0.1-1 FPKM)和結腸(1-3 FPKM)中含量較低。
OR51E2在前列腺癌中表達增強。因此,它也被鑒定為前列腺特異性G蛋白偶聯受體(PSGR),并被認為是前列腺腫瘤的標記物。然而,Cao等人報道,PSGR在前列腺上皮內瘤變中表達較高,但隨著疾病進展為前列腺癌而降低。在前列腺癌患者中,發現低PSGR表達與較差的總生存期相關。OR51E2在人類黑色素瘤細胞中的數量要高于黑色素細胞。此外,最近的另一項研究表明OR51E2是人類成人和胎兒視網膜色素上皮中表達最多的OR轉錄本。有趣的是,OR51E2不僅存在于質膜中,還存在于良性和惡性前列腺上皮細胞、視網膜色素上皮細胞和黑色素細胞的胞漿中;特別是在黑素細胞的早期核內體抗原1中。
紫羅蘭酮的香氣與藥理活性
β-紫羅蘭酮具有多種藥理作用,包括抗癌、化學預防、促癌、促黑、抗炎和抗菌活性。幾種機制和細胞內信號級聯已被報道解釋這些效應。β紫羅酮激活OR51E2和調節細胞周期調控蛋白的活動或表現,促進細胞凋亡(pro-apoptotic)和抗凋亡蛋白,β-還原酶和促炎介質。
1、激活OR51E2-調控效果
研究表明β-紫羅蘭酮通過激活OR51E2抑制前列腺癌細胞增殖并誘導其侵襲,而β-紫羅蘭酮介導的OR51E2激活抑制黑素細胞增殖和遷移并誘導黑素生成。令人驚訝的是,β-紫羅蘭酮介導的OR51E2激活增加視網膜色素細胞的增殖和轉移,激活p44/42和蛋白激酶B (AKT)蛋白。
β-紫羅蘭酮激活OR51E2導致激酶活性的調節和細胞內鈣離子的增加(圖1)。Neuhaus團隊發現,β-紫羅蘭酮激活OR51E2(而不是雄激素受體(AR))導致前列腺癌原發上皮細胞和前列腺癌細胞株細胞內鈣離子濃度的增加(LNCaP)。進一步的實驗表明,β-i紫羅蘭酮通過磷酸化p38和應激活化蛋白激酶/Jun氨基末端激酶(SAPK/JNK)發揮抗增殖作用,它們是絲裂原活化蛋白激酶(MAPK)家族的成員。另一項研究發現β-紫羅蘭酮通過調節MAPK通路抑制乳腺癌細胞的增殖。
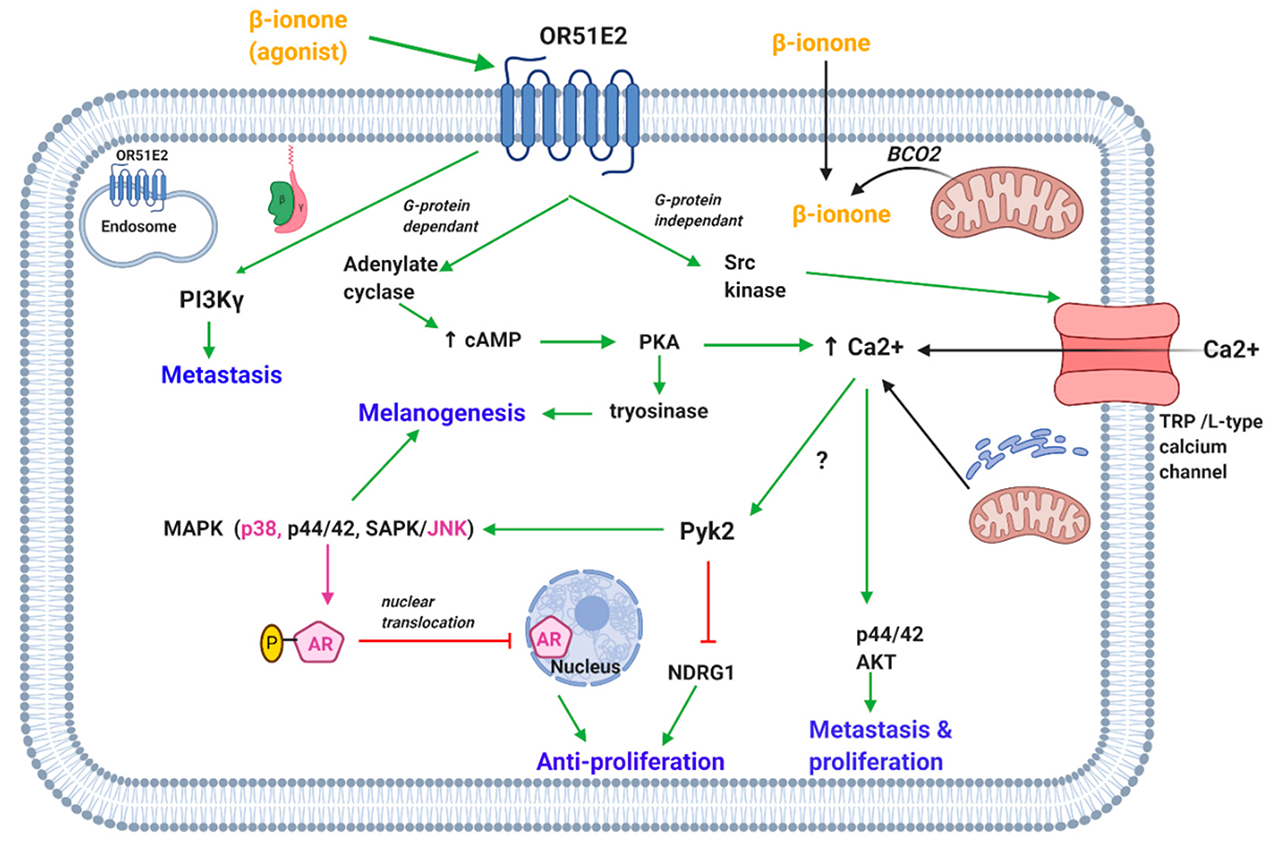
圖1. β-紫羅蘭酮介導的膜和胞質OR51E2受體的激活導致鈣離子的增加和調節調節細胞增殖、轉移和黑素生成的各種激酶的作用。(OR51E2,嗅覺受體51E2;BCO2, β-胡蘿卜素氧合酶2;cAMP,環磷酸腺苷;PKA,蛋白激酶A;TRP鈣通道,瞬時受體電位鈣通道;Pyk2,富含脯氨酸的酪氨酸激酶2;MAPK,絲裂原活化蛋白激酶;SAPK/JNK,應激活化蛋白激酶/Jun氨基末端激酶;NDRG1, N-myc下游調控基因1;基于“增大化現實”技術,雄激素受體;AKT,蛋白激酶B;PI3K?,磷酸肌醇3-激酶gamma)。[5]
Wiese等人表明,富含脯氨酸的酪氨酸激酶2 (Pyk2)在OR51E2激活后啟動的信號級聯中發揮關鍵作用(圖1)。β-紫羅蘭酮通過OR51E2)激活前列腺癌細胞中的Pyk2,可能是通過細胞內鈣離子濃度的增加介導的。Pyk2增加p38 MAPK的磷酸化和N-myc下游調控基因1 (NDRG1)的去磷酸化。后者和Pyk2被認為負責β-紫羅蘭酮介導的前列腺癌細胞的抗增殖作用。此外,本研究發現β-紫羅蘭酮激活OR51E2可調控前列腺癌細胞信號轉導和離子轉運等過程中的各種蛋白。
Jones等人支持β-紫羅蘭酮的抗增殖作用與AR無關的觀點。然而,Xie等人最近的一項研究表明AR的存在是β-紫羅蘭酮激活OR51E2所必需的。OR51E2刺激β-紫羅蘭酮誘導的前列腺癌細胞株(LNCaP, C4-2和DU145)發生鈣內流。然而,它僅抑制LNCaP和C4-2細胞的前列腺癌增殖,而這兩種細胞在DU145細胞中不表達AR,值得注意的是,β-紫羅蘭酮誘導的OR51E2的激活通過p38和jnk介導的AR磷酸化抑制了AR核轉位(圖1)。AR轉位的抑制導致了AR轉位激活的減少,從而阻礙了前列腺癌細胞的生長。這進一步得到了體內研究的支持,該研究表明β-紫羅蘭酮抑制小鼠腫瘤生長,并引起AR、p38和JNK磷酸化的增加。
然而,Sanz報道β-紫羅蘭酮通過激活OR51E2刺激介導的磷脂酰肌醇-4,5-二磷酸3-激酶-?(PI3K?)誘導前列腺癌(LNCaP)細胞侵襲(圖1)。G蛋白的β?亞基激活PI3K?。Cao等的一項研究表明,β-紫羅蘭酮介導的OR51E2的激活抑制了C4-2細胞的增殖,但促進了它們的侵襲,這與LNCaP細胞的報道數據一致。值得注意的是,β-紫羅蘭酮對前列腺腫瘤小鼠也能誘導細胞轉移。另一方面,另一項研究發現β-紫羅蘭酮聯合索拉非尼(一種多激酶抑制劑)對人肝癌細胞的轉移具有協同抑制作用。這是通過β-紫羅蘭酮誘導組織抑制劑基質金屬蛋白酶-1和-2表達上調來介導的,這是一種被廣泛接受的轉移抑制方法。
研究表明β-紫羅蘭酮還通過激活OR51E2抑制黑素細胞的增殖。然而,β-紫羅蘭酮通過誘導凋亡降低了lpa誘導的遷移,并延緩了垂直生長期(vertical-growth phase, VGP)黑色素瘤細胞的生長。β-紫羅蘭酮則增加了黑素細胞的黑色素水平和兩樹突以上細胞的百分比。β-紫羅蘭酮激活OR51E2介導黑素生成,激活腺苷酸環化酶,從而增加cAMP和蛋白激酶A (PKA)的激活。PKA可能負責上調黑素生成酶酪氨酸酶(圖1)。此外,活化的MAPK (p44/42和p38)也可能是黑素生成的調節因子。結果表明,外部信號是由細胞膜上的OR51E2而不是細胞質內的OR51E2接收的。在此基礎上,假定OR51E2通過β-紫羅蘭酮對黑素細胞的重復刺激被插入細胞膜。
為此,研究探討了OR51E2刺激下前列腺癌細胞鈣離子增加的機制。瞬時受體電位香草樣6 (transient receptor potential vanilloid type 6, TRPV6)通道在β-紫羅蘭酮介導的OR51E2激活下游被激活。Src激酶在β-紫羅蘭酮介導的鈣內流中起關鍵作用;OR51E2直接激活Src激酶而不依賴于G蛋白的激活(圖1)。
β-紫羅蘭酮也可引起黑色素細胞和轉移性和VGP培養細胞內鈣濃度的增加,在前列腺腫瘤細胞中有報道。這一過程也通過激活表面OR51E2介導。來自細胞外空間和細胞內儲存的鈣是鈣水平升高的原因,然而,發現前者是主要的顯著貢獻者(圖1)。細胞外鈣通過瞬時受體電位通道特別是TRPM注入,而不是前列腺癌細胞中報道的TRPV。
另一項研究表明β-紫羅蘭酮誘導視網膜色素上皮細胞內鈣離子的增加;鈣起源于細胞外空間。鈣的增加是通過激活cAMP通路介導的。雖然沒有發現鈣通道,但推測與之有關的是l型鈣通道或TRP通道(如前列腺和黑色素細胞)。
看來,通過飲食和香味提供的外源性β-紫羅蘭酮可能會激活質膜中的OR51E2。然而,有人提出,線粒體內BCO2內源性產生的β-紫羅蘭酮也可能激活細胞內OR51E2。上述細胞中已經出現OR51E2的胞內定位。根據β-紫羅蘭酮的疏水特性,它可以穿越細胞膜,因此,這似乎表明外源性、內源性β-紫羅蘭酮均可能激活質膜,或胞質存在的OR51E2。
2、細胞周期調節蛋白介導的作用
β紫羅酮可以抑制乳腺癌細胞增殖,前列腺癌,人類結腸癌,人類胃腺癌,小鼠黑色素瘤B16細胞,人類白血病和結腸腺癌細胞株和體內乳腺癌腺,通過誘導細胞周期阻滯。
β-紫羅蘭酮已被證明可通過使乳腺癌細胞系的細胞周期停滯在G1/G0期、人類結腸癌和前列腺癌細胞系(DU145、PC-3細胞)的G1期[以及人類胃癌和乳腺癌細胞系的G1/G0和G2/M期來抑制細胞增殖。
細胞增殖受細胞周期的調節。細胞周期蛋白、細胞周期蛋白依賴性激酶(CDK)和CDK抑制劑(CdkI)在調節細胞周期方面起著關鍵作用。細胞周期停滯是由細胞周期蛋白D1、細胞周期蛋白E、細胞周期蛋白B1、細胞周期蛋白A、Cdk2、Cdk4的減少解釋的(圖2)。Cdk對參與細胞周期進展的蛋白質進行磷酸化。Cdk只有在與細胞周期蛋白復合形成Cdk-細胞周期蛋白復合體時才會被激活。Cdk4-環蛋白D、Cdk2-環蛋白E、Cdk2-環蛋白A、Cdk1-環蛋白A和Cdk1-環蛋白B分別調節早期G1期、晚期G1期、S期的進展、G2/進入M期和M期的進展(圖2)。
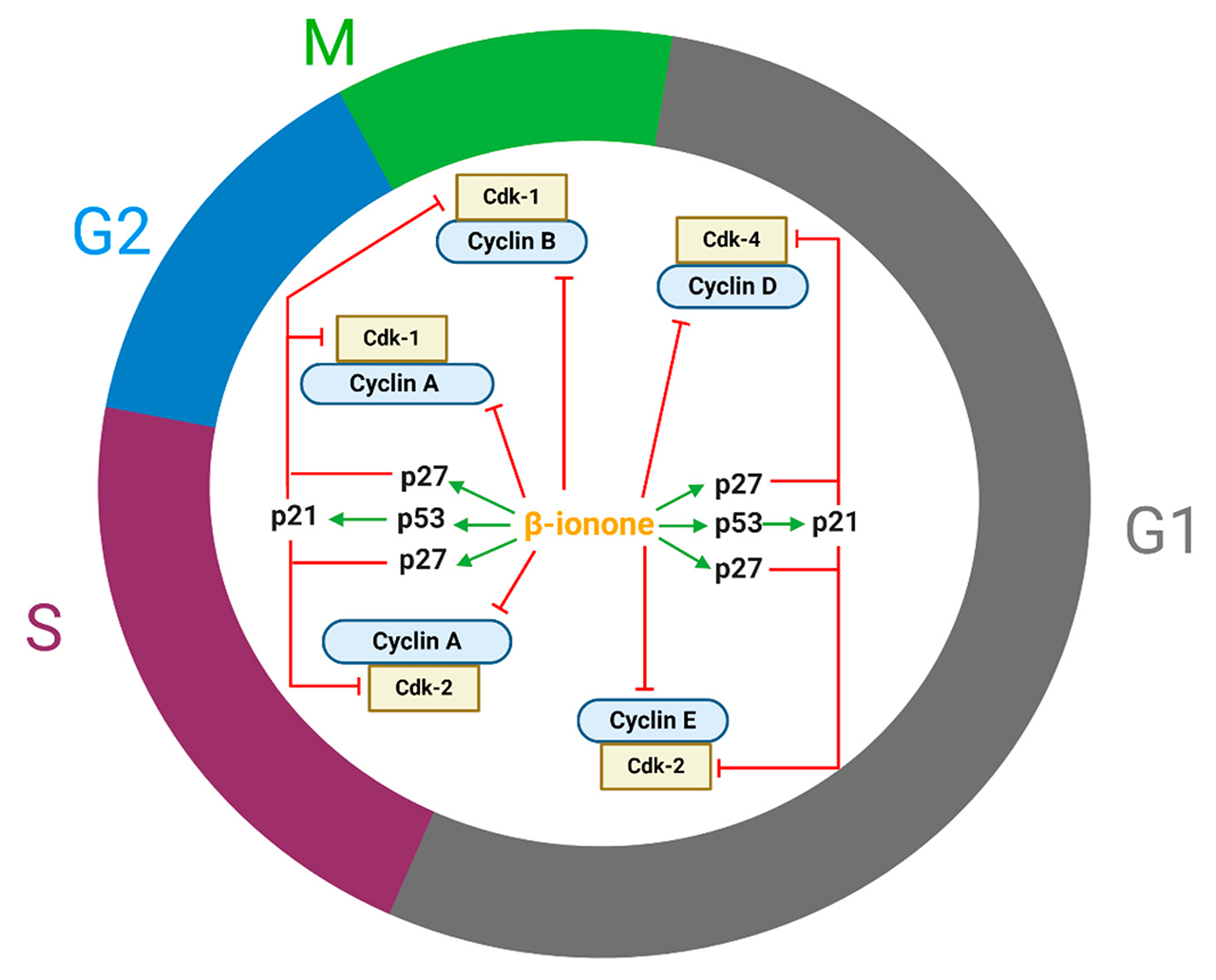
圖2. β-紫羅蘭酮調節幾個細胞周期調節蛋白,導致各種癌細胞的細胞周期停滯(Cdk-1,細胞周期蛋白依賴性激酶-1;Cdk-2,細胞周期蛋白依賴性激酶-2;Cdk-4,細胞周期蛋白依賴性激酶-4;p27,細胞周期蛋白依賴性激酶抑制劑;p21,細胞周期蛋白依賴性激酶抑制劑)。
此外,有報道稱β-紫羅蘭酮增強了p27的表達,這也可以解釋細胞周期停滯,從而導致細胞生長遲緩。據認為,β-紫羅蘭酮在七癌認知的早期階段針對持久性腫瘤前病變的p53。P53主要通過p21的轉錄激活來調節細胞周期停滯。P21和p27是CdkI,與Cdk-周期素(cyclin)復合物結合并阻斷其活性,特別是涉及周期素(cyclin) A、B、D和E的復合物(圖2)。此外,有人提出,細胞周期停滯可能是通過MAPK途徑調節的;如Dong等人表明,β-紫羅蘭酮抑制了細胞外信號調節激酶的表達,并誘導了p38和SAPK/JNK的表達。
3、凋亡的影響
β-紫羅蘭酮通過誘導細胞凋亡誘導乳腺癌腺體和乳腺癌、白血病和人類胃腺癌細胞系的細胞凋亡。β-紫羅蘭酮誘導的細胞凋亡是通過減少抗凋亡蛋白Bcl-2的表達和增加促凋亡蛋白Bax的表達來實現的(圖3)。此外,β-紫羅蘭酮增加了乳腺癌和人類胃腺癌細胞系中裂解的胱天蛋白酶(Caspase)-3的表達。據認為,在肝癌發生的早期階段,β-紫羅蘭酮針對持久性腫瘤前病變中的p53具有靶向作用(圖3)。然而,β-紫羅蘭酮誘導細胞凋亡的作用以前被證明是獨立于突變的p53功能的。
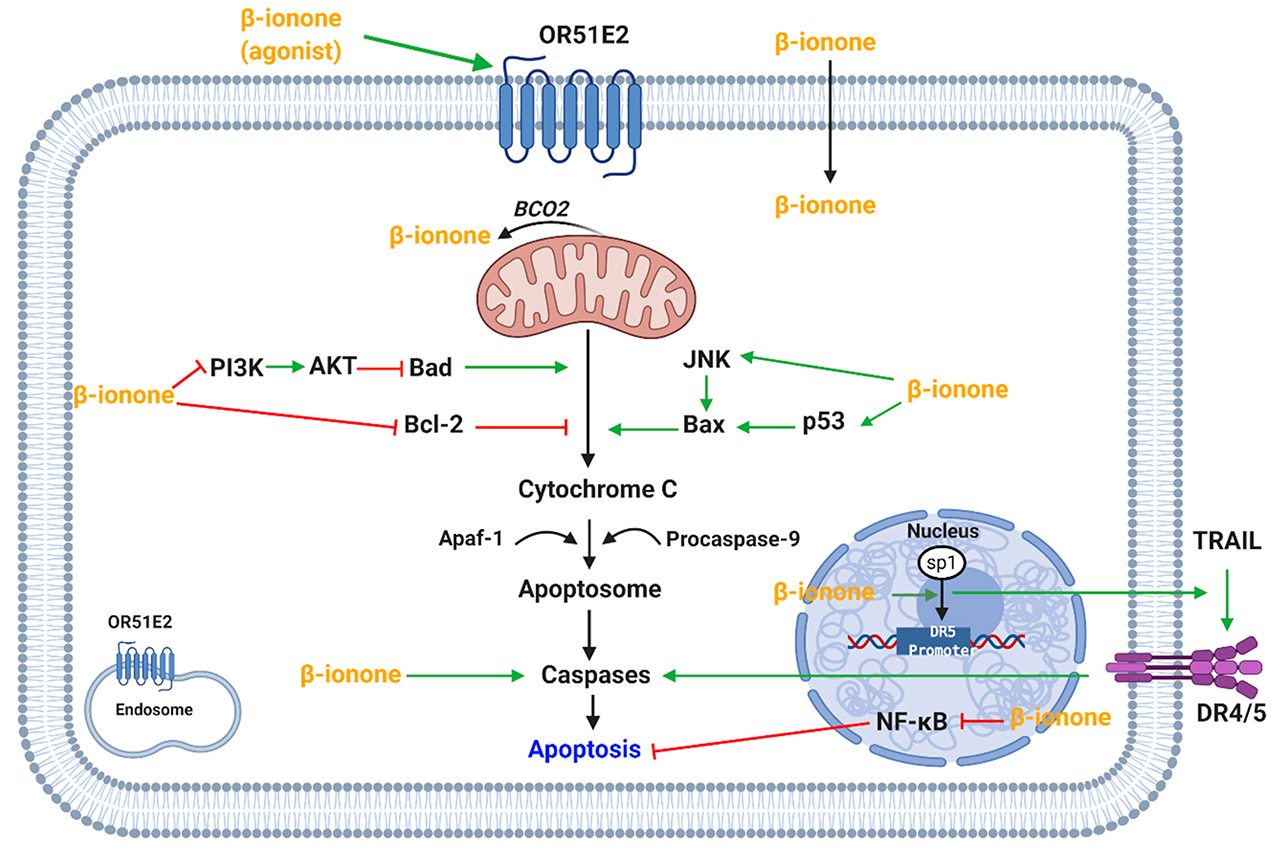
圖3 β-紫羅蘭酮調節促凋亡和抗凋亡通路的機制。(OR51E2,嗅覺受體51E2;BCO2, β-胡蘿卜素加氧酶2;JNK, Jun氨基末端激酶;AKT,蛋白激酶B;PI3K,磷酸肌醇3-kinase;Apaf-1,凋亡蛋白酶活化因子1;TRAIL,腫瘤壞死因子相關凋亡誘導配體;DR4/5,死亡受體4/5;NF - Bк-κB核因素;轉錄因子SP1;特異性蛋白1;DR5啟動子,死亡受體5啟動子)
此外,有報道稱PI3K(磷酸肌醇3-激酶)磷酸化蛋白和AKT表達水平降低。PI3K-AKT通路也可以解釋細胞凋亡,該通路參與細胞增殖、生存和細胞信號轉導(圖3)。進一步的研究證實了MAPK通路在細胞增殖和凋亡中的作用,磷酸化p38的增加被證實。這些研究表明,細胞凋亡可能通過MAPK或PI3K-AKT途徑介導。
Liu等人發現,β-紫羅蘭酮對大鼠的乳腺癌發生有劑量依賴性的抑制作用;腫瘤的繁殖率下降,腫瘤出現時間增加。此外,還發現增殖細胞核抗原的減少和核分裂的增加。此外,發現β-紫羅蘭酮能使細胞對TRAIL(腫瘤壞死因子相關凋亡誘導配體)刺激的凋亡敏感。這是通過增加轉錄因子Sp1與DR5啟動子位點的直接結合,取消NF-κB的激活和減少抗凋亡蛋白的表達而介導的(圖3)。另一項研究發現,β-紫羅蘭酮在肝癌發生的早期階段,針對頑固的腫瘤前病變的NF-коB。
Janakiram等人發現,β-紫羅蘭酮可能通過在人類結腸癌細胞中作為視黃醇X受體-α(RXR-α)的配體而誘導細胞凋亡。β-紫羅蘭酮被發現在細胞中劑量依賴性地增加RXR-α mRNA的表達水平。此外,RXR-α的表達在其他癌細胞中也被發現有所減少。值得注意的是,RXR-α mRNA的表達不僅在大鼠結腸腺癌中減少,而且在前列腺癌的基底細胞中也減少;提出它對癌癥進展的影響。β-紫羅蘭酮和β-胡蘿卜素/維生素A之間的結構相似性進一步支持了這一點,β-紫羅蘭酮被認為可以與RXRs結合。然而,β-紫羅蘭酮在體內對大鼠結腸異常隱窩的影響是有爭議的,因為研究報告顯示對異常隱窩的抑制或沒有影響。
4、HMG CoA還原酶介導的效果
3-羥基-3-甲基戊二酰輔酶A(HMG CoA)還原酶負責合成甲羥戊酸。甲羥戊酸是甾醇分子(如膽固醇)和非甾醇異構體(如多萜醇、泛醌、焦磷酸法尼基和焦磷酸香葉香葉基)的前體。膽固醇在膜的完整性中起著重要的作用,而非固醇類異戊二烯類化合物則參與了各種細胞過程。香葉香葉基焦磷酸酯和法尼基焦磷酸酯使蛋白質(翻譯后修飾),如Ras、Rho和Rac GTP酶家族,這又在細胞增殖、血管生成和生存中起著重要作用。
抑制HMG CoA還原酶與細胞凋亡、細胞周期停止和增殖抑制有關。據報道,他汀類藥物是公認的HMG-CoA還原酶的抑制劑,具有抗癌活性。在腫瘤細胞中,HMG-CoA還原酶對甾醇調節的反饋抑制有抵抗力(圖4),因此其在各種類型的癌癥中上調。然而,腫瘤細胞中的HMG CoA還原酶對由非甾醇化合物介導的轉錄后抑制很敏感。還發現異戊二烯類化合物可以轉錄后抑制HMG-CoA還原酶的活性。

圖4. β-紫羅蘭酮介導的對HMG-CoA還原酶的抑制導致了抗增殖作用和膽固醇水平的降低。(OR51E2,嗅覺受體51E2;BCO2,β-胡蘿卜素加氧酶-2;HMG CoA,3-羥基-3-甲基戊二酰輔酶A;PP,焦磷酸)。
飲食中的β-紫羅蘭酮可以抑制雞的血清總膽固醇水平和HMG CoA活性,同時提高HDL水平。β-紫羅蘭酮對大鼠乳腺癌發生的化學預防作用與它對HMG-CoA還原酶的抑制作用平行。Espindola等人報告說,較高劑量的β-紫羅蘭酮(16毫克/100克)可抑制腫瘤前病變的細胞增殖,并在肝癌發生的初始階段引起較小的可見肝細胞結節。值得注意的是,血漿總膽固醇的水平隨著更高劑量的β-紫羅蘭酮的給藥而下降。其他研究發現,β-紫羅蘭酮對小鼠B16黑色素瘤、乳腺癌、人類白血病、人類結腸腺癌和前列腺腫瘤細胞系生長的抑制是通過降低HMG CoA還原酶的活性來實現的。β-紫羅蘭酮酮與洛伐他汀或反式、反式法尼醇(參與抑制還原酶的化合物)之間報告的協同抗增殖活性進一步證實了這一點。
β-紫羅蘭酮對HMG-CoA活性的抑制是通過轉錄后作用介導的。β-紫羅蘭酮對HMG CoA活性的抑制是通過間接促進HMG CoA的降解來解釋的。這是通過誘導焦磷酸戊酯焦磷酸酶的活性來介導的,而焦磷酸戊酯焦磷酸酶又會增加法尼醇的水平,法尼醇是一種非甾體的甲狀腺素產物,可降解HMG CoA還原酶(圖4)。此外,β-紫羅蘭酮和洛伐他汀影響了核纖層蛋白B的翻譯后修飾,而核纖層蛋白B是在間期組裝核膜的一個重要作用。因此,有人認為β-紫羅蘭酮介導的對HMG CoA-還原酶的抑制抑制了核纖層蛋白B的核定位,從而導致DNA易受內切酶的影響。這種作用將導致細胞凋亡,正如β-紫羅蘭酮和洛伐他汀所描繪的那樣。此外,β-紫羅蘭酮和洛伐他汀引起細胞周期停止在G1期。因此,β-紫羅蘭酮和斯達汀共同調節HMG-CoA和協同抗增殖作用支持β-紫羅蘭酮作為癌癥的輔助治療,以減少斯達汀的副作用。
我們認為β-紫羅蘭酮可能以類似于斯達汀的方式直接抑制HMG-CoA還原酶,因為β-紫羅蘭酮看起來與斯達汀的藥理結構有相似的骨架(圖4)。此外,最近的一項研究表明,與斯達汀結構完全不同的化合物也能夠抑制HMG-CoA還原酶。
盡管如此,Duncan和他的同事表明,β-紫羅蘭酮可以抑制乳腺癌細胞的增殖和細胞周期,而不影響HMG CoA還原酶的活性。β-紫羅蘭酮被發現具有化學保護作用,因為它減少了可見肝細胞結節的平均數量,以及持續的腫瘤前病變,在大鼠肝癌發生的整個起始階段造成DNA損傷。值得注意的是,β-紫羅蘭酮增加了肝癌大鼠的肝臟HMG-CoA還原酶mRNA水平,但降低了血漿總膽固醇的水平。這種還原酶mRNA水平的增加可能是HMG CoA降解后的一種補償機制。法尼醇對HMG CoA還原酶和膽固醇有類似的影響,這支持了所記錄的法尼醇可以調節β-紫羅蘭酮的活性的結論。
5、抗氧化劑介導的效果
Asokkumar提出,β-紫羅蘭酮的抗增殖活性可歸因于其抗氧化特性。苯并(a)芘是一種著名的致癌物,被選擇來誘發小鼠肺癌,因為它被認為會產生活性氧并啟動增殖變化。β-紫羅蘭酮的抗增殖作用是通過減少增殖細胞核抗原的表達和恢復癌癥標志酶(癌胚抗原和神經元特異性烯醇化酶)的正常水平來顯示的。對小鼠施用β-紫羅蘭酮可使酶(如過氧化氫酶、谷胱甘肽過氧化物酶(GPx)、谷胱甘肽-S-轉移酶、谷胱甘肽還原酶(GR)和超氧化物歧化酶(SOD))和非酶抗氧化劑(如谷胱甘肽(GSH)、維生素E和C)的活性恢復到苯并(a)芘處理前的水平(圖5)。
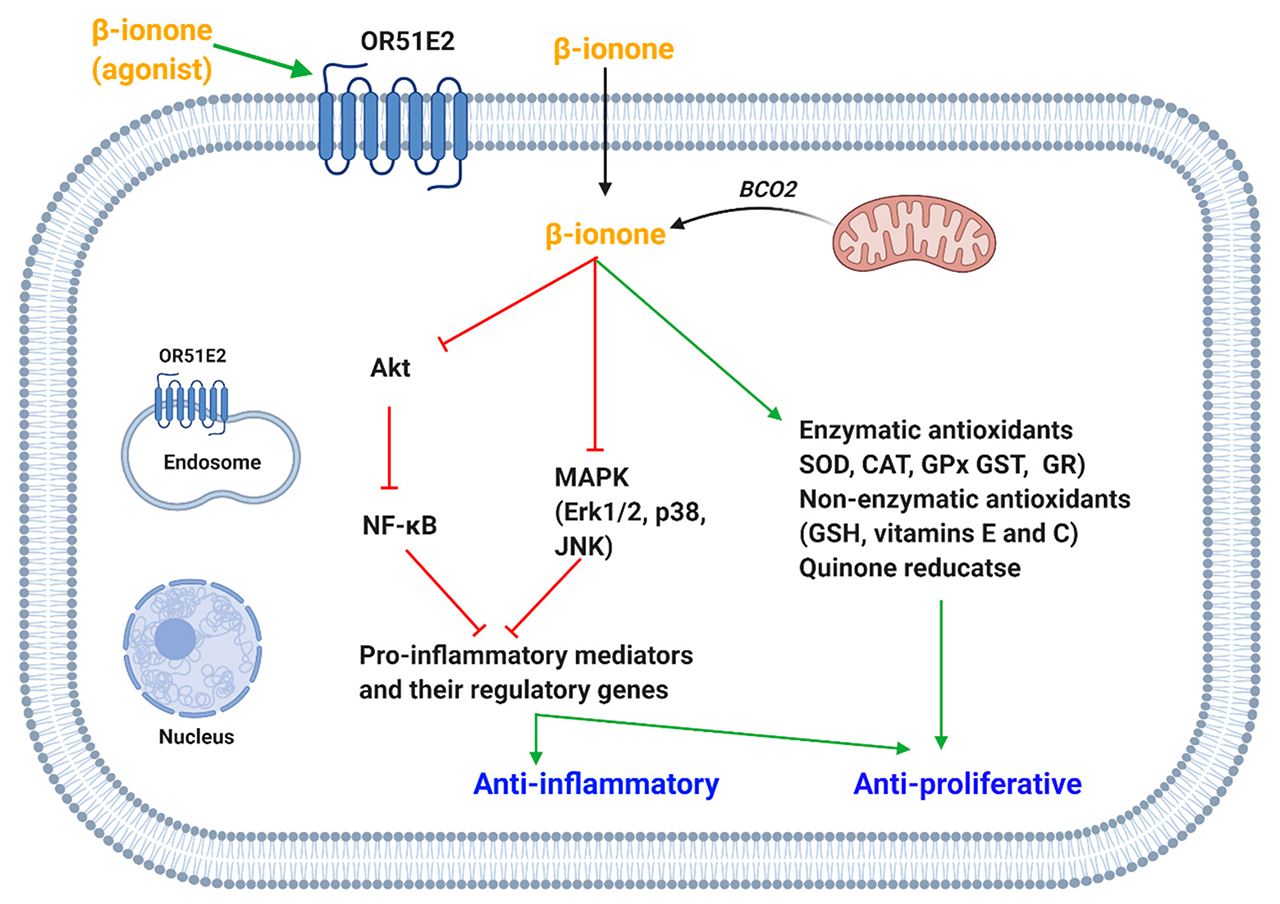
圖5. β-紫羅蘭酮抑制促炎癥介質和誘導/恢復抗氧化劑引起抗增殖和抗炎作用。(OR51E2,嗅覺受體51E2;BCO2,β-胡蘿卜素氧合酶-2;MAPK,有絲分裂原激活的蛋白激酶;JNK,Jun氨基末端激酶;AKT,蛋白激酶B;NF-кB,核因子-κB。Erk1/2,細胞外信號調節激酶1/2;SOD,超氧化物歧化酶;CAT,過氧化氫酶;GPx,谷胱甘肽過氧化物酶;GST,谷胱甘肽-S-轉移酶;GR,谷胱甘肽還原酶;GSH,谷胱甘肽)。
另一項研究表明,β-紫羅蘭酮具有化學保護作用,并抑制了7,12-二甲基苯(a)蒽誘導的大鼠乳腺癌的發生。它增加了抗氧化酶(GPx、GR、SOD)和GSH的活性。β-紫羅蘭酮的抗氧化作用進一步得到了脂質過氧化、丙二醛(氧化應激的標志物)和一氧化氮(一種活性氮物種)的減少的證明。Dong等人表明,在Hepa1c1c7細胞上應用β-紫羅蘭酮可以增強醌還原酶的活性,這是一種第二階段的解毒酶。β-紫羅蘭酮如何產生抗氧化作用的確切機制仍不清楚。然而,對醌還原酶的影響可能是通過對p38的調節來解釋的,p38是第二階段解毒酶激活的一個負面調節器。
6、促炎癥分子介導的影響
β-紫羅蘭酮抑制COX-2在人類胃癌細胞和大鼠乳腺腫瘤組織中的表達,這可能解釋了其抗增殖作用。此外,人胃癌細胞中前列腺素E2(PGE2)的釋放也有所減少。Kang支持β-紫羅蘭酮對脂多糖(LPS)誘導的促炎癥介質的表達有抑制作用。據報道,在LPS誘導的BV2小膠質細胞中,β-紫羅蘭酮減弱了一氧化氮(NO)、前列腺素E2(PGE2)和腫瘤壞死因子-α(TNF-α)的釋放以及誘導性NO合成(iNOS)、環氧化酶-2和TNF-α的蛋白質和mRNA表達。研究發現,β-紫羅蘭酮通過抑制NF-κB和MAPK途徑調節這些炎癥介質(圖5)。作者表明,β-紫羅蘭酮通過延緩Akt的活性降低了NF-κB的DNA結合活性。此外,β-紫羅蘭酮抑制了MAPKs(Erk、p38和JNK)的磷酸化,而MAPKs是釋放促炎癥介質的重要調節器。
7、抗菌作用
Griffin和他的同事研究了結構基團在決定幾種萜類化合物的抗菌活性中的作用。β-紫羅蘭酮對大腸桿菌和白色念珠菌有抑制活性。β-紫羅蘭酮抑制了黃曲霉的生長和黃曲霉和寄生蟲的孢子繁殖。此外,暴露在β-紫羅蘭酮下,無性繁殖結構的形態發生了改變。值得注意的是,黃曲霉的孢子中的黃曲霉毒素積累量急劇減少。
8、α-紫羅蘭酮
如前所述,β-紫羅蘭酮作為OR51E2的激動劑。另一方面,α-紫羅蘭酮對OR51E2的活性并不明確。一些研究報告說,α-紫羅蘭酮拮抗OR51E2,它阻止或抑制了β-紫羅蘭酮的作用,特別是它被用來證實OR51E2被β-紫羅蘭酮激活。例如,Neuhaus發現α-紫羅蘭酮對細胞內鈣濃度沒有影響,它抑制了β-紫羅蘭酮誘導的細胞內鈣的增加和對前列腺癌細胞的抗增殖作用。
相反,Sanz等人表明,α-紫羅蘭酮是OR51E2的真正激動劑。值得注意的是,α-紫羅蘭酮主要誘導LNCaP細胞和小鼠前列腺腫瘤的生長,而β-紫羅蘭酮則增加細胞的侵襲性。這些發現與GPCR的偏向激動現象相一致。因此,有人提出,每種離子素誘導不同的下游信號級聯,取決于G蛋白或β-抑制蛋白(arrestin)的耦合。
此外,α-紫羅蘭酮根據其劑量引起不同的反應;中等劑量可增強LNCaP細胞的侵襲性,而高劑量則沒有(相反,它可維持細胞生長)。有人提出,α-紫羅蘭酮會根據劑量的不同調節不同的細胞信號級聯。例如,α-紫羅蘭酮可能部分或完全激活了OR51E2,從而引發了不同的下游信號級聯。這也可能意味著α-紫羅蘭酮在較高的劑量下會拮抗OR51E2。然而,在轉染的HEK293細胞中,較高劑量的α-紫羅蘭酮激活OR51E2支持前一種假設。
紫羅蘭酮,特別是β-紫羅蘭酮,可以通過BCO2內源性產生或通過飲食外源性提供。無論是內源性的還是外源性的,β-紫羅蘭酮都具有抗癌、化學預防、抑制黑色素生成、抗炎和抗菌的活性。β-紫羅蘭酮通過激活OR51E2和調節HMG CoA還原酶、細胞周期調節蛋白、促凋亡和抗凋亡途徑、促炎癥細胞因子和抗氧化酶來介導這些作用。OR51E2的激活導致調節各種激酶的活性和細胞內鈣離子的增加。OR51E2的激活導致前列腺癌細胞的抗增殖作用和轉移,黑色素細胞的抗增殖作用和黑色素生成以及視網膜色素上皮細胞的增殖和轉移。
歸因于β-紫羅蘭酮的廣泛效應和各種信號級聯可能是由于不同的細胞匯合體而產生。此外,β-紫羅蘭酮可能與廣泛的受體相互作用,不限于OR51E2,如報道的與AR和RXR-α的相互作用。此外,β-紫羅蘭酮可能在不同的細胞內區劃中激活細胞質OR51E2。這是基于β-紫羅蘭酮的疏水特性,使其能夠穿越細胞膜。
β-紫蘿蘭酮和α-紫羅蘭酮衍生物表現出抗炎、抗微生物和抗癌作用。建議進一步研究β-和α-紫羅蘭酮衍生物與各種報道的生理作用之間的結構活性關系。然而,大多數研究都同意,連接在β-紫羅蘭酮上的環狀分子上的電子抽出取代基會產生更好的抗癌和抗微生物活性。
總的來說,這些數據表明,β-紫羅蘭酮是一個有前途的治療癌癥、炎癥和傳染病研究的骨架結構,因此它不僅僅是一個紫羅蘭的香味。
參考文獻
[1] Rose (Rosa damascena) , John C. Leffingwell
[2] NODA, C., ALT, G. P., WERNECK, R. M.; 等. Aldol Condensation of Citral with Acetone on Basic Solid Catalysts. Braz. J. Chem. Eng. 1998, 15 (2). doi:10.1590/S0104-66321998000200004.
[3] Alfred Russell and R. L. Kenyon. Pseudoionone. Organic Syntheses, Coll. Vol. 3: 78. [2013-09-15].
[4] Elisabetta Brenna, Claudio Fuganti, Stefano Serra, and Philip Kraft, Optically Active Ionones and Derivatives: Preparation and Olfactory Properties, Eur. J. Org. Chem., 2002, S. 967–978.
[5] Aloum L, Alefishat E, Adem A, Petroianu G. Ionone Is More than a Violet’s Fragrance: A Review. Molecules. 2020; 25(24):5822. https://doi.org/10.3390/molecules25245822