服務熱線
177-5061-9273

樟腦,又稱莰酮、龍腦酮(Borneon);是從龍腦氧化后所獲得的產物,天然樟腦是右旋光性,若化學合成則是消旋品。
| 中文名稱 | 右旋樟腦 |
| 英文名稱 | (+)-Camphor |
| 精油來源 | 樟樹(本樟)、頭狀薰衣草、西洋耆草、樟腦迷迭香 |
| 氣味描述 | 強烈又刺激的甜味,有點汽油味 |
| 芳療功效 | 1.局部抗發炎、止癢、局部麻醉止痛,應用在各種發癢皮膚病,能迅速解除患部不適 |
| 2、強心活血,應用在肌肉關節疼痛、退化性關節炎等筋骨問題 | |
| 3、用于居家環境,可強力驅蟲(蟑螂)、防蛀(白蟻)、防腐(微菌) | |
| 心靈功效 | 防止歲月的蛀蟲啃食自己的心靈,預防因循茍且、食古不化 |
| 注意事項 | 1、高濃度涂抹皮膚會造成接觸性皮膚炎;高濃度口服會造成惡心、嘔吐、頭暈、神經抽搐、痙攣、癲癇、蠶豆癥禁用;2、孕婦禁用,樟腦物質會穿透胎盤、影響胎兒神經發展,甚至造成流產;3、 嬰幼兒禁用。其口服致死量為1g/kg,高濃度外圍可能造成呼吸困難、昏迷 |
樟腦,IUPAC名稱1,7,7-三甲基二環[2.2.1]庚烷-2-酮,是一種萜類有機化合物,室溫下為白色或透明的蠟狀固體,可用于驅離蠹魚,但對蟑螂、蚊子等居家常見生物沒有顯著驅離作用。在歷史上,樟腦使用在制藥用途,也是重要的軍火及工業原料。在塑膠石化工業尚未普及時,樟腦為制作塑化材質重要的原料,如賽璐珞底片。諾貝爾在1887年以樟腦為原料研制出了威力更強的新式火藥“無煙火藥”,使樟腦成為國際貿易中關注的重要資源。
樟腦提煉自樟樹干中,樹齡越老的樟樹所富含的樟腦比例越多。提煉方法為將樹干切成小塊用水蒸餾,樟腦油受熱后隨著水蒸汽上升,在接觸到預先放置在上方的陶缸冷卻后便可形成樟腦。
臺灣早期北部、中部山林多為原始樟樹林,老樟樹樹齡千年以上者甚多,在十九世紀后半葉及二十世紀初,臺灣山林的樟樹林成為國際貿易中關注的重要資源。漢人巨商墾民、英國商人、清廷政府、日本政府先后在臺灣大量砍伐樟腦輸出,臺灣樟腦輸出量在日治時曾達世界首位,有“樟腦王國”之稱。
過去使用的樟腦丸多使用萘與萘酚,因此又稱為萘丸;由于萘有一定毒性且可能致癌,現在則大部分被對二氯苯所取代,而不使用樟腦。
樟腦結構式
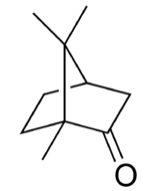
| CAS號 | 76-22-2 464-48-2((S)) 464-49-3((R)) 21368-68-3 [76-22-2] [464-49-3] ((1R)-樟腦) [464-48-2] ((1S)-樟腦} |
| PubChem | 2537 9543187((R)) 10050((S)) |
| ChemSpider | 2441, 7822160 (R), 9655 (S) |
| 化學式 | C10H16O |
| 摩爾質量 | 152.23 g·mol?1 |
| 外觀 | 白色或無色晶體 |
| 密度 | 0.990 |
| 熔點 | 179.75 °C (453K) |
| 沸點 | 204 °C (477 K) |
| 溶解性(水) | 0.12 g / 100 ml |
| 溶解性(氯仿) | ~100 g / 100 ml |
反應
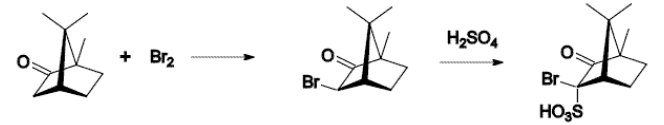
樟腦可發生的典型反應有:
溴化反應:
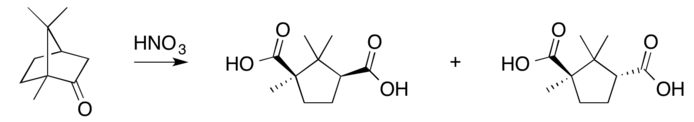
硝酸氧化:
生成異亞硝基樟腦
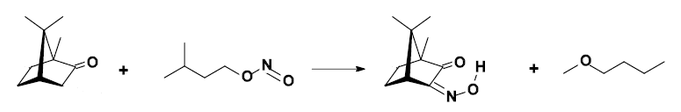
以硼氫化鈉還原樟腦可得(異龍腦)冰片。
生物合成
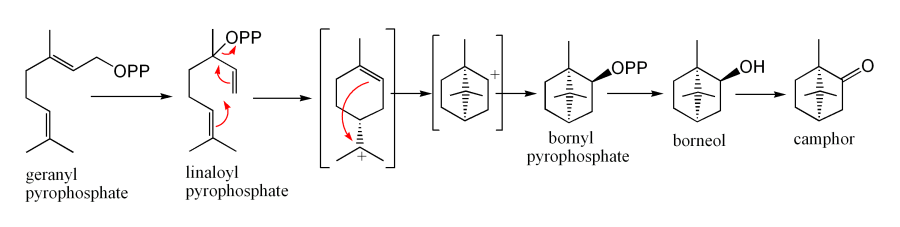
用途
樟腦的用途很多,除了使用在制藥用途上,也是重要的工業原料。在早期塑膠較不普及時,樟腦為制作底片重要的原料,當時臺灣輸出的樟腦達到世界第一,其中北部以三角涌(今三峽)、大嵙崁(今大溪)、咸菜甕(今關西),及中部南投的集集等地為樟腦產出最興盛的地區。樟腦一般制成樟腦丸,用于驅蟲、除臭。樟腦具毒性,不可直接食用。
對于有六磷酸葡萄糖去氫素(G6PD)缺乏癥(通稱蠶豆癥)的患者,建議勿接觸或使用含樟腦 (camphor) 之外用藥品。
1887年諾貝爾利用樟腦研制出了新式火藥,煙霧較少的“無煙火藥”,此種火藥威力更強,能使敵方不容易發現自己。
歷史
6世紀時阿拉伯發明了樟腦制法,16世紀時傳入日本,當時主要產地為薩摩藩(現鹿兒島縣)。當時樟腦之主要用途為賽璐珞的可塑劑,隨后以樟腦為原料威力更強的新式火藥發明后,需求量大增。
臺灣早期北部、中部的淺山森林多為原始千年樟樹林,自荷治時期以來,就有樟腦出口,當時平地甚至延伸至海岸都有濃密的樟樹林。18世紀初清廷將樟樹貿易收歸國有專賣,私砍林木可被處死,單單1720年就因私砍林木而有超過200個人被斬首,后來引爆了朱一貴事件。事平后政策才松綁,繳交規費即可取得進入樟木林工作的許可。初期山林土地的所有人平埔族尚能收取墾民繳交的規費,到了19世紀初,漢人即漸漸奪取山林所有權及樟樹貿易的獨占地位。
在十九世紀后半葉及二十世紀初,臺灣樟腦生產量幾乎占全世界的一半以上,臺灣山林的樟樹林成為國際貿易中關注的重要資源。1855年臺灣當地官員與美商私訂密約,1858年天津條約將臺灣(今臺南安平)開放為通商口岸,隨后又增開淡水、打狗(今高雄港)、雞籠(今基隆港)等口岸,美商與俄商、德商、英商等即先后進入臺灣收購樟腦進行樟腦出口貿易。為壟斷樟腦獨占地位,臺灣當地官員亦欲介入利益,在1863年違反天津條約將樟腦改為官辦專賣,與英商間不斷的沖突在1868年引發與英軍的樟腦糾紛。
1880年代臺灣建省首任巡撫劉銘傳與地方巨商,為掠奪山林資源、壟斷樟腦獨占利益(劉銘傳在奏折中自稱為“伐木裕餉”),繼續執行開山撫番政策,由地方巨商向政府官員捐輸買官、提供民勇人丁,官員發動戰爭劫掠搶取土地,租給地方巨商招募民工腦丁入墾山林,所得再租稅裕餉,如此循環,七年間持續發動一連串大嵙崁戰役以帝國優勢現代武力征伐今大溪、三峽、復興、烏來等地的泰雅部落。
日治時延續清末開山撫番政策,隨后更升級為理蕃政策,不承認族人領地權將山林強制沒收為國有,樟腦業者墾民入侵部落領地開墾伐林不再付予當地住民賽夏、泰雅等部落租金補償,不斷暴力沖突終至引發南莊事件、大豹社事件等事件。至當地社群滅社后,引進工業化資本主義,大舉經營臺灣的樟腦產業全面收歸國家壟斷臺灣北部、中部山林樟樹之采伐,到了20世紀初日本成為全世界最大的樟腦生產國。
1920年代,化學合成制法逐漸流行,逐漸取代樟腦的地位,最終由于塑膠被發明、取代賽璐珞,樟腦產業就此沒落。
樟腦的藥理活性
1、樟腦在一種與香蘭素無關的機制中激活并強烈脫敏瞬時受體電位香蘭素亞型1通道
樟腦是一種自然產生的化合物,作為一種主要的有效成分的香油和搽劑提供局部止痛劑。盡管樟腦在醫學上的使用歷史悠久,但其作用的潛在分子機制尚不清楚。辣椒素和薄荷醇是另外兩種廣泛應用于類似目的的外用藥物,已知它們通過作用于瞬時受體電位(TRP)通道超家族的兩種成員:熱敏TRP香草樣亞型1 (TRPV1)和冷敏TRP通道M8來刺激和脫敏感覺神經。樟腦最近被證明可以激活TRPV1,在這里,我們發現樟腦也可以激活異型表達的TRPV1,這需要比辣椒素更高的濃度。通過模擬炎癥條件的磷脂酶c偶聯受體刺激增強了激活。在分離的大鼠DRG神經元中觀察到類似樟腦激活的trpv1樣電流,并在蛋白激酶C被佛波醇12-十四酸酯-13-乙酸酯(佛波酯,是蛋白激酶 C (PKC) 和 SphK 的激活劑)激活后增強。大鼠TRPV1的樟腦激活是由辣椒素不同的通道區域介導的,這表明樟腦激活存在競爭性抑制劑辣椒素和辣椒素不敏感點突變體。樟腦并沒有激活辣椒素不敏感的雞肉TRPV1。TRPV1脫敏被認為有助于辣椒素的鎮痛作用。我們發現,雖然樟腦對TRPV1的激活作用較弱,但樟腦對TRPV1的脫敏作用比辣椒素更快、更徹底。相反,反復使用樟腦后TRPV3電流變得敏感,這與樟腦的鎮痛作用不一致。我們還發現樟腦抑制了其他幾個相關的TRP通道,包括錨蛋白-重復TRP 1 (TRPA1)。樟腦誘導TRPV1脫敏和TRPA1阻滯可能是樟腦鎮痛作用的基礎。[1]
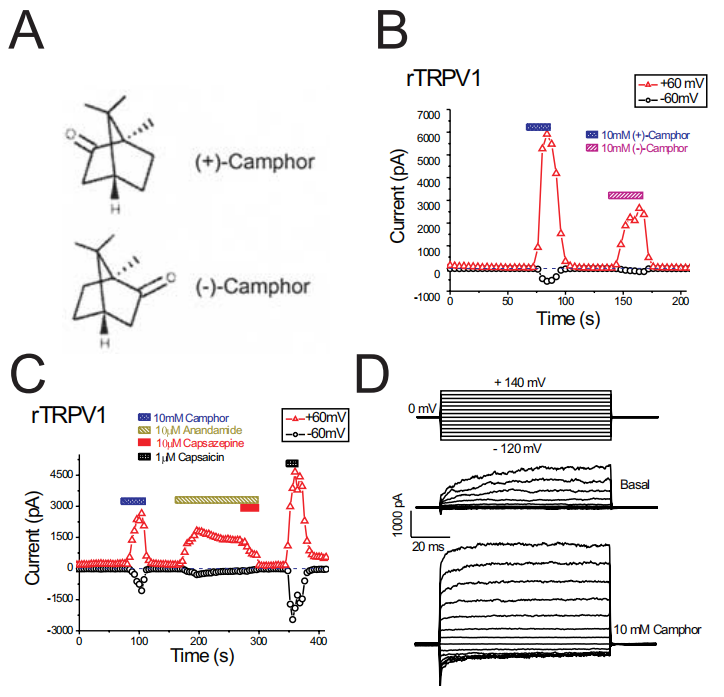
樟腦激活異型表達的大鼠TRPV1。A、樟腦(+)和(-)立體異構體的結構。B,兩種樟腦立體異構體都激活了rTRPV1。(-)-樟腦與(+)-樟腦的作用較弱,可能是由于速發型過敏反應。每隔4秒施加400 ms從-100到+100 mV的電壓斜坡誘發斜坡電流。每個符號表示+60mv(紅色三角形)和-60mv(黑色圓圈)處的電流振幅。注意零電流水平(用藍色虛線表示)。c, rTRPV1被樟腦,anandamide和辣椒素激活。辣椒素(10M)對anandamide誘導的電流有很強的抑制作用。D,樟腦對rtrpv1介導的電壓步進電流的影響。[1]
2、樟腦白油通過細胞毒性T細胞依賴機制誘導腫瘤消退
樟樹(Cinnamomum camphora)的生物活性衍生物已被證實具有化學預防作用,但這些天然產物的功效和作用機制尚未確定。我們測試了一種精油衍生物,樟腦白油(CWO),對角質細胞來源的皮膚癌小鼠模型的抗腫瘤活性。每日局部治療CWO可誘導惡性前皮膚腫瘤顯著消退,皮膚鱗狀細胞癌減少兩倍。我們下一步研究潛在的細胞和分子機制。在培養的角化細胞中,CWO刺激鈣信號轉導,導致鈣調神經依賴激活T細胞核因子(NFAT)的激活。在體內,CWO誘導免疫相關基因的轉錄變化,導致細胞毒性T細胞依賴性腫瘤消退。最后,我們確定了CWO的化學成分,概括了外加劑的作用。總之,這些研究確定T細胞介導的腫瘤消退是植物來源的精油減少既定腫瘤負荷的機制。[2]
我們提出,CWO通過NFAT依賴信號和CD8+ T細胞依賴機制刺激皮膚腫瘤消退(下圖)。與NFAT信號的參與相一致,我們的體外研究表明,CWO誘導了人角質形成細胞中的鈣信號和鈣/鈣調神經磷酸酶依賴的NFAT易位。[2]
NFAT信號在角質形成細胞中的作用是多方面的和環境相關的。例如,Notch信號下游的NFAT激活已被證明可以誘導表皮角化細胞從增殖到分化的轉換(Mammucari, Tommasi di Vignano, 2005, Santini, Talora, 2001)。在毛發周期中,NFAT信號通過抑制細胞周期調節因子CDK4促進膨大干細胞的靜止(Horsley, Aliprantis, 2008, Mammucari, Tommasi di Vignano, 2005, Santini, Talora, 2001)。相比之下,表皮細胞中NFAT的過度激活促進角質形成細胞的過度增殖(Tripathi, Wang, 2014)。后一項報告與我們的發現一致,CWO促進正常人類角質形成細胞的增殖。[2]
如何增強角質細胞增殖與腫瘤消退相協調?一種可能是,CWO導致正常角質形成細胞增殖,并在代謝資源方面勝過癌癥干細胞。另外,NFAT的激活可能會對正常干細胞和癌癥干細胞產生不同的影響,促進前者的增殖,后者的沉默(Tripathi, Wang, 2014, Wu, Nguyen, 2010)。總的來說,這種增殖潛能的改變可以改變尺度,促進腫瘤消退。[2]
我們發現CWO在體內的抗腫瘤作用需要免疫細胞,這有利于另一種模型:CWO促進角質形成細胞NFAT易位,誘導細胞因子表達,改變腫瘤微環境,通過免疫細胞激活刺激腫瘤細胞清除。例如,最近的研究發現胸腺基質淋巴細胞生成素(TSLP)在角質形成細胞中釋放NFAT激活下游(Wilson et al., 2013)。TSLP以促進過敏性炎癥的作用而聞名(Ziegler, 2012),當從角質形成細胞中釋放時,可以促進特應性進程,進而促進哮喘的發展(Zhang et al., 2009)。有趣的是,過敏性炎癥可以降低某些癌癥的風險,同時增加其他癌癥的風險(Josephs等人,2013年)。一些有趣的研究表明,TSLP通過CD4+和CD8+ t細胞激活在刺激抗腫瘤免疫方面具有額外的作用(Demehri et al., 2016, Demehri et al., 2012, Di Piazza et al., 2012)。角質形成細胞釋放的TSLP可直接刺激CD4+ TH激活和細胞毒性T細胞向腫瘤募集。有趣的是,我們發現CWO處理后的角質形成細胞中TSLP mRNA表達上調,提示這一信號通路可能有助于CWO介導的腫瘤消退。
除了對角質形成細胞的影響外,CWO還可以直接作用于T細胞,既可以通過皮膚中的居民群體作用,也可以通過全身作用(Medler & Coussens, 2014, Mueller等人,2014,Richmond & Harris, 2014)。NFAT亞型因其對T細胞的作用而被大量研究(Hogan, 2017)。在T細胞激活時,核NFAT蛋白與AP1轉錄因子結合,刺激與激活相關的基因表達。因此,CWO可以通過NFAT直接影響T細胞的活化動力學。未來研究的目標是確定CWO是否直接作用于角化細胞、免疫細胞或兩者都能刺激抗腫瘤免疫。[2]
綜上所述,本研究確定CWO是一種新型的NFAT信號和鈣調磷酸酶介導的抗腫瘤免疫激活劑。接受鈣調磷酸酶抑制劑長期治療的器官移植受者SCC風險顯著增加(Dotto, 2011, Goldstein, Fletcher, 2014, Horsley, Aliprantis, 2008, Keyes, Segal, 2013, Yamamoto & Kato, 1994),認為NFAT激活劑可能用于降低上皮腫瘤風險。由于這些研究調查了CWO和萜類化合物在誘導腫瘤后的療效,因此需要進一步研究確定這些化合物是否也可以作為一種預防措施,減少癌前病變的發展。這增加了CWO可以作為一種有效的局部治療,以防止角化細胞衍生性病變的進展的可能性。[2]
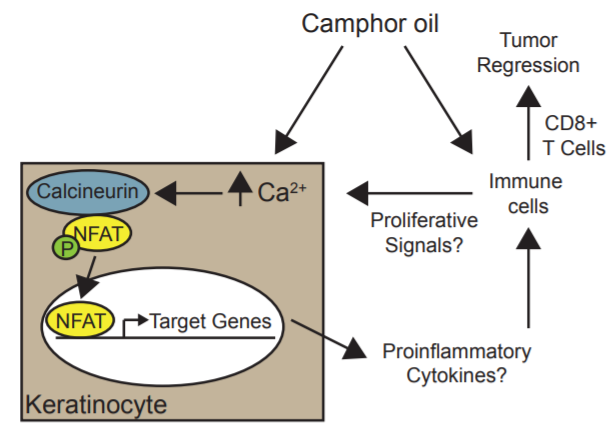
CWO的作用機制模型。CWO誘導鈣/鈣調素依賴性NFAT易位。NFAT誘導轉錄,進而改變腫瘤微環境,促進炎癥和T細胞介導的腫瘤消退。[2]
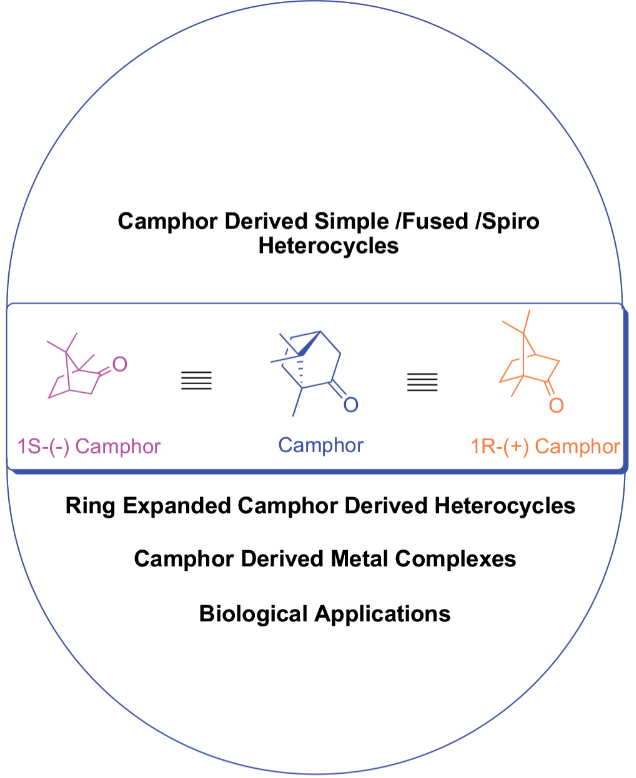
3、樟腦衍生物及其應用的研究進展
天然化合物是藥物化學中合成豐富的生物活性物質的重要來源。樟腦以兩種對映體形式存在,即R和S,或兩者都存在,這是很容易得到的。樟腦是一種具有手性的小分子,它與某些活性位點結合,樟腦是廣泛存在于植物中的一種重要的單萜類化合物,它是樟腦衍生物的原料,具有抗菌、抗病毒、抗氧化、抗氧化、止痛和抗癌等多種生物活性。許多這些簡單的衍生物在商業上以樟腦磺酸或酮酸的形式存在,可以很容易地從樟腦中生產出來。該化合物主要用作天然產物對映體特異性合成的手性起始材料,因為其可用于直接或間接引入C-3、C-5、C-8、C-9和C-10碳原子的功能。本研究將從樟腦中提取的雜環化合物按不同的基團排列,包括樟腦簡單雜環化合物、樟腦融合雜環化合物、螺環類樟腦衍生雜環化合物、環擴張型樟腦衍生雜環化合物和樟腦衍生金屬配合物。本研究綜述了樟腦及其衍生物的轉化及其生物活性。
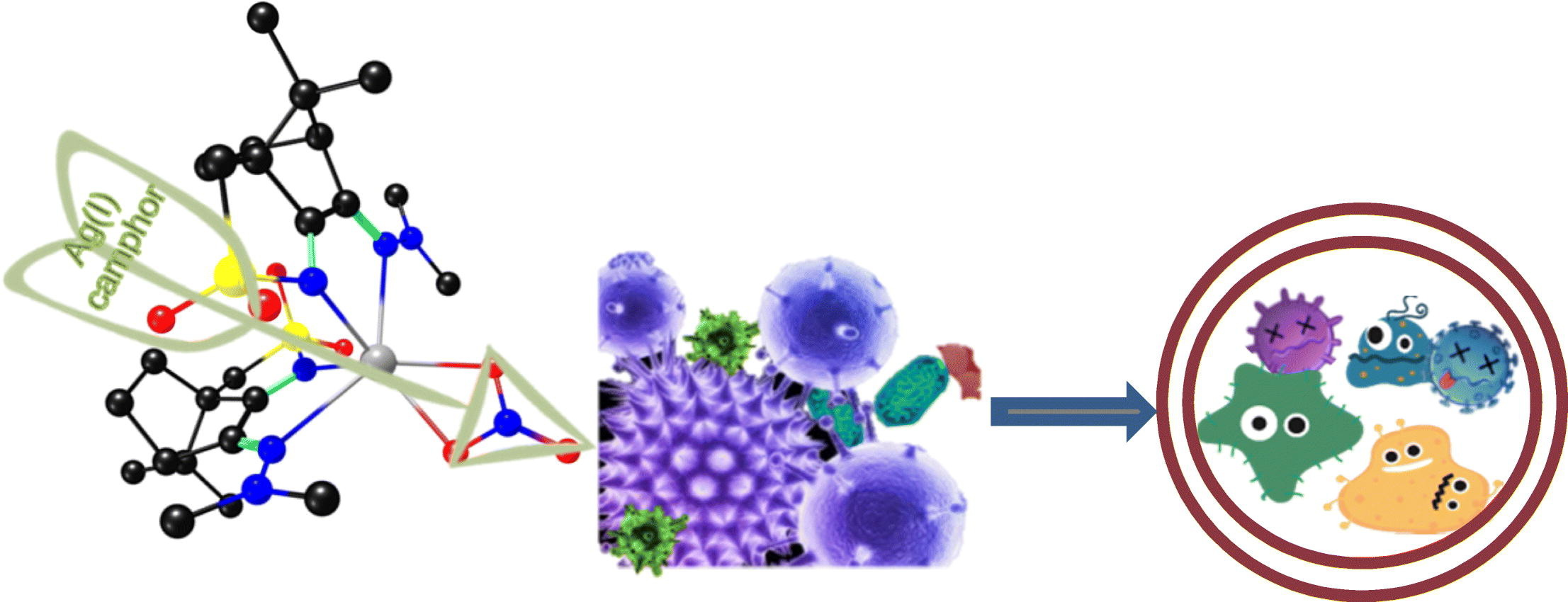
4、銀(I)樟腦復合物:設計抗菌活性
與Ag(I)樟腦亞胺配合物[Ag(NO3)(OC10H14NY)2] (Y=NMe2(1))相對應的11個分子式[Ag(NO3)(L-Y)2]新配合物哦,(2);C6H5 (3);4-MeC6H4, (4);3, 5 - (CH3) 2 c6h3 (5);3-OHC6H4, (6);3-ClC6H4 (7);4-ClC6H4 (8);4-FC6H4 (9);合成了4-CF3C6H4(10)和樟腦磺酰亞胺配合物[Ag(NO3)(O2SNC10H14NY)2] (Y=NH2),并對其結構和抗菌活性進行了研究。選取其中5個配合物作為典型算例,用密度泛函理論計算優化了配合物的結構。結果表明,樟腦配體上的亞胺取代基(Y)驅動配合物的結構由扭曲的八面體向三角棱柱或線性離子轉變,而磺酰亞胺環的作用對配合物的幾何形狀沒有明顯的影響。化合物的親脂性和極性是關系到其生物活性的重要參數,同時也與樟腦配體的特性密切相關。用循環伏安法研究了配合物的氧化還原性質,結果表明,它們的還原電位基本上與它們的電子和空間性質無關。通過MIC值計算各配合物對革蘭氏陽性菌(金黃色葡萄球菌Newman)和革蘭氏陰性菌(大腸桿菌ATCC25922、銅綠假單胞菌477、伯克霍爾德菌IST408)的抑菌活性。結果表明,樟腦亞胺配體(1 ~ 10)配合物具有高脂親和低偶極矩(3 ~ 5)的抗菌活性。建立氫鍵的能力是樟腦磺酰亞胺配合物11 (Y=NH2)抗菌活性的重要貢獻。[4]
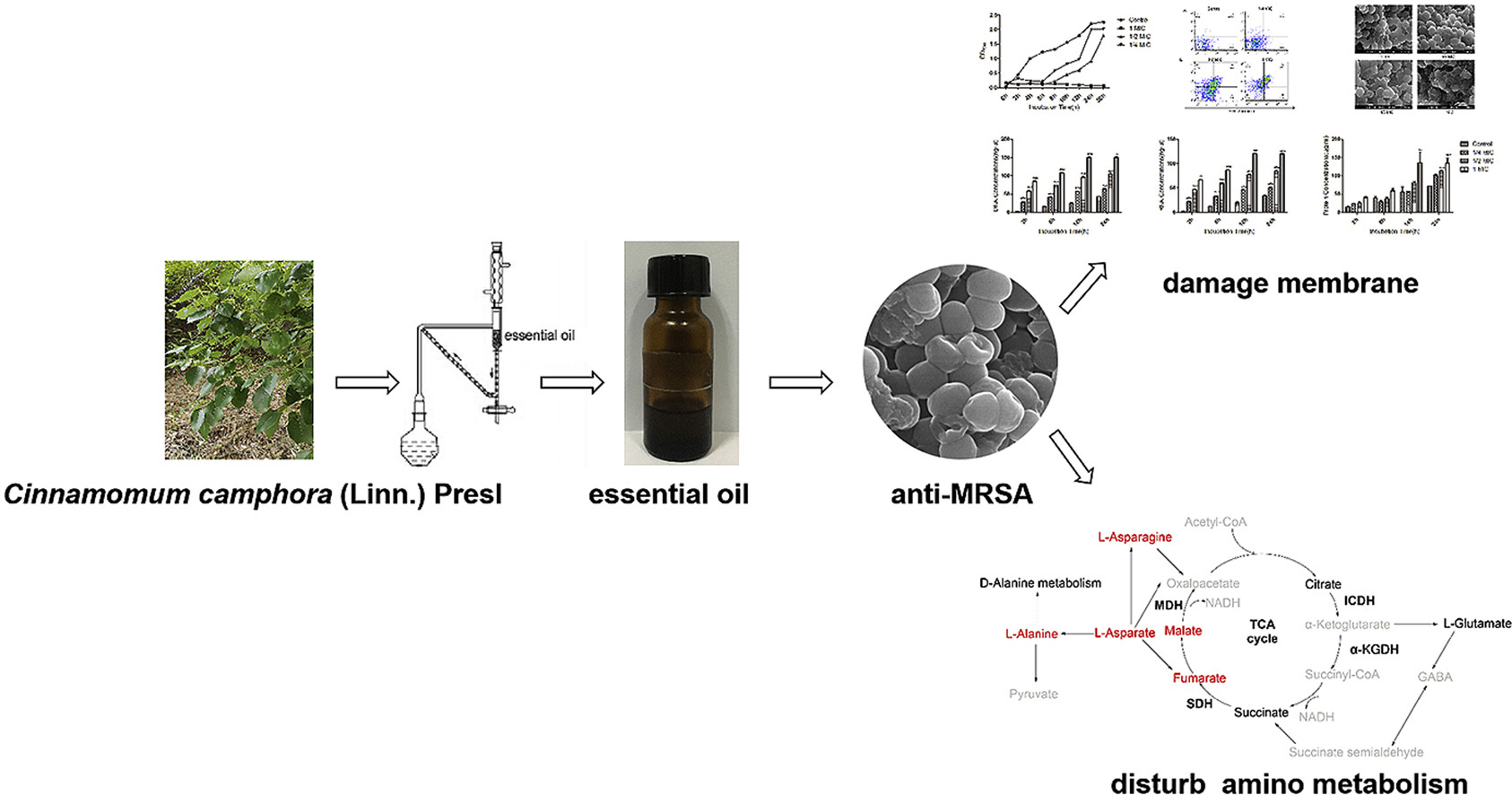
5、用代謝組學方法評價香樟葉揮發油的抑菌活性
香樟(Presl camphora)是最古老的傳統中草藥之一,具有抗菌、抗氧化、抗真菌、抗炎、殺蟲、驅避等多種生物功能。客觀的研究了香樟精油的抑菌活性及抑菌機理。采用水蒸氣蒸餾法從香樟葉中分離得到精油,并采用氣相色譜-質譜聯用技術(GC-MS)對精油的化學成分進行分析。用微肉湯稀釋法測定精油的最小抑菌濃度(MIC)和最小殺菌濃度(MBC)。用比濁法測定生長曲線。流式細胞術檢測細胞凋亡。用場發射掃描電鏡和透射電鏡觀察細菌的形態變化。用NanoDrop和BCA蛋白檢測試劑盒檢測細胞膜的完整性。利用GC-MS代謝組學研究精油存在下耐甲氧西林金黃色葡萄球菌(MRSA)的代謝譜。采用商品化試劑盒檢測異檸檬酸脫氫酶(ICDH)、α-酮戊二酸脫氫酶(α-KGDH)、琥珀酸脫氫酶(SDH)和蘋果酸脫氫酶(MDH)活性。結果發現,香樟葉精油的主要成分為芳樟醇(26.6%)、桉葉醇(16.8%)、α-松油醇(8.7%)、異龍腦醇(8.1%)、β-水芹烯(5.1%)和樟腦(5.0%)。精油對金黃色葡萄球菌、糞腸球菌、枯草芽孢桿菌、雞沙門氏菌和大腸桿菌均有較好的抑制活性。以MRSA為模型菌闡明精油的抗菌作用機理,其MIC值為0.8 mg/mL, MBC值為1.6 mg/mL。添加精油后,MRSA凋亡率呈濃度依賴性增加。精油破壞細胞形態。在代謝組學評價結果中,有74個代謝產物差異顯著,其中29個代謝產物上調,45個代謝產物下調。七種途徑被共享的差異代謝物豐富了。精油使ICDH活性提高47.35%,MDH、SDH和α-KGDH活性分別降低72.63%、31.52%和63.29%。樟樹精油通過破壞細胞膜和干擾氨基代謝表現出抗耐甲氧西林金黃色葡萄球菌活性。
參考文獻
[1] Xu, Haoxing & Blair, Nathaniel & Clapham, David. (2005). Camphor Activates and Strongly Desensitizes the Transient Receptor Potential Vanilloid Subtype 1 Channel in a Vanilloid-Independent Mechanism. The Journal of neuroscience : the official journal of the Society for Neuroscience. 25. 8924-37. 10.1523/JNEUROSCI.2574-05.2005.
[2] Yalda Moayedi, Sophie A Greenberg, Blair A Jenkins, Kara L Marshall, Lina V Dimitrov, Aislyn M Nelson, David M Owens, Ellen A Lumpkin. Camphor white oil induces tumor regression through cytotoxic T cell-dependent mechanisms. bioRxiv 386789; doi: https://doi.org/10.1101/386789
Now published in Molecular Carcinogenesis doi: 10.1002/mc.22965
[3] Anjaneyulu Bendi, Sangeeta and Saini Naina , A Study on Camphor Derivatives and Its Applications: A Review, Current Organic Chemistry 2021; 25(12) . https://dx.doi.org/ 10.2174/ 13852 72825666210608115750
[4] M. Fernanda N.N. Carvalho, Silvestre Leite, Joana P. Costa, Adelino M. Galv?o, Jorge H. Leit?o,Ag(I) camphor complexes: antimicrobial activity by design,Journal of Inorganic Biochemistry,Volume 199,2019,110791,doi.:10.1016/j.jinorgbio.2019.110791.
[5] Yuquan Huang, Xinjun Xu, Wenjian Lan, Depo Yang, Metabolomics analysis to evaluate the antibacterial activity of the essential oil from the leaves of Cinnamomum camphora (Linn.) Presl, Journal of Ethnopharmacology,Volume 253,2020,112652,doi.10.1016/j.jep.2020.112652.