服務熱線
177-5061-9273

側柏酮—苦艾酒的重要成分;少量能使意識進入到奇幻國度,產生朦朧快感,激發(fā)出創(chuàng)造潛能。研究報告指出,側柏酮會抑制人體制造神經傳導物質GABA(Gamma-amino butyric acid)γ-氨基丁酸。GABA可以抑制或阻斷神經細胞過度興奮,讓人的身心狀態(tài)寧靜、平和及放松下來。如果缺少GABA,會造成失眠、精神緊張、歇斯底里等精神異常狀況。這也就是誤用高劑量側柏酮后的中毒狀況。自然界中有α-和β-兩種異構體。[1]
表1 側柏酮的功效及來源
| 中文名稱 | α-側柏酮 | β-側柏酮 |
| 英文名稱 | α-Thujone | β-Thujone |
| 精油來源 | 側柏、鼠尾草、艾草 | 南木蒿 |
| 氣味描述 | 清新甜美 | 清澈、苦味、帶有沙塵感 |
| 芳療功效 | 興奮中樞神經系統(tǒng)、通經、促進細胞再生 | 與α型相同,但是效果減弱許多,因此較無神經毒性 |
| 心靈功效 | 在狂亂與平靜中找尋平衡 | 內心無限寬廣、擴大 |
| 注意事項 |
| |
側柏酮(英語:Thujone)又稱“崖柏酮”或“守酮”,是一種酮以及一種單萜,天然存在于兩個非對映體形式:(?)-α-側柏酮和(+)β-側柏酮。側柏酮類似有薄荷醇的氣味。盡管有關側柏酮最廣為人知的是,它是苦艾酒中所含的一種化學物質,但最近的研究表明苦艾酒只含有少量側柏酮,所以側柏酮可能不是報道中提及的苦艾酒能致幻的原因。側柏酮能作用于大腦中的GABA受體和5-HT3受體。許多國家都對食物或飲料中側柏酮的含量的都做了限制。除了天然的(?)-α-側柏酮和(+)β-側柏酮的,理論上側柏酮還存在另外兩個對映體形式:(+)-α-側柏酮和(?)β-側柏酮:[2]
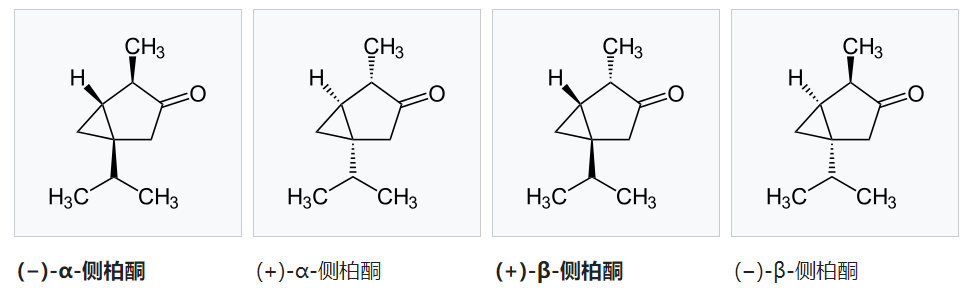
IUPAC名:α: (1S,4R,5R)-4-Methyl-1-(propan-2-yl)bicyclo[3.1.0]hexan-3-one
β: (1S,4S,5R)-4-methyl-1-(propan-2-yl)bicyclo[3.1.0]hexan-3-one
CAS號: 471-15-8(β-側柏酮) 546-80-5(α-側柏酮)
PubChem:261491,11027
ChemSpider:229574 (α-側柏酮), 82583 (β-側柏酮)
InChIKey:USMNOWBWPHYOEA-MRTMQBJTBZ
ChEBI:9577
化學式:C10H16O
摩爾質量:152.23 g·mol(-1)
密度:0.92 g/cm3(β-側柏酮)
沸點:201 ℃(β-側柏酮)
若非注明,所有數據均出自一般條件(25 ℃,100 kPa)下。
側柏酮的應用
CN201811394406.7公開了一種負氧離子納米凈醛噴劑,包括以下重量組份:親核去醛原料10-18份、離子水30-55份、物理去醛原料8-15份、氧化去醛原料12-25份、光觸媒去醛原料10-13份與殺菌原料5-8份、防輻射原料6-11份;親核去醛原料包括以下重量組份:異丙胺3-5份、苯酚8-16份與氨溶液6-12份;物理去醛原料包括以下重量組份:無機納米硅8-14份、硅藻純3-6份與納米礦晶6-12份;防輻射原料包括以下重量組份:茶多酚5-10份、側柏酮2-8份與前花青素3-4份。本發(fā)明能夠達到四重凈化甲醛的效果,分別通過物理阻礙方法、氧化反應方法、親核反應方法與光觸媒方法來阻礙甲醛擴散與甲醛中和反應生成二氧化碳與水,該噴劑還具有防輻抗癌,提神驅寒等對身體健康有益的功效。[3]
CN201610417280.5公開一種基于香料閾值的木香香型煙用香精及其調配方法,其由下述重量百分比的原料組成:香基1-20%,溶劑80-99%;其中,香基各組分的重量份組成見如下:側柏酮0.5-5.0份、柏木醇0.1-2.0份、乙酸松油酯0.5-5.0份、愈創(chuàng)木醇0.5-5.0份、愈創(chuàng)木酚0.1-2.5份、廣藿香醇0.1-1.0份、香紫蘇內酯0.2-3.0份。將本發(fā)明木香香型煙用香精添加到煙絲中,采用本領域常規(guī)技術制成卷煙產品,感官評價試驗結果表明:和未添加本發(fā)明木香香型煙用香精的空白樣相比,添加后的卷煙樣品香氣質變好,香氣量明顯增加,且改善了余味,掩蓋了雜氣。[4]
(-)-α-側柏酮
| 常用名 | (-)-α-側柏酮 | 英文名 | α-Thujone |
| CAS號 | 546-80-5 | 分子量 | 152.23300 |
| 密度 | 0.914 g/mL at 20oC(lit.) | 沸點 | 84-86oC17 mm Hg(lit.) |
| 分子式 | C10H16O | 熔點 | 181oC |
| 閃點 | 148 °F |
α-側柏酮 是一種從西方金鐘柏精油中分離出來的單萜,具有有效的抗腫瘤活性。α-側柏酮 是 GABAA 受體的可逆調節(jié)劑,在抑制 GABA 誘導的電流時,α-側柏酮 的 IC50 為 21 μM。α-側柏酮誘導ROS依賴性細胞毒性,還誘導細胞凋亡 (apoptosis ) 和自噬 (autophagy)。α-側柏酮具有抗傷害,殺蟲和驅蟲活性,并且很容易穿透血腦屏障。
(-)-α-側柏酮物理化學性質
| 密度 | 0.914 g/mL at 20oC(lit.) |
| 沸點 | 84-86oC17 mm Hg(lit.) |
| 熔點 | 181oC |
| 分子式 | C10H16O |
| 分子量 | 152.23300 |
| 閃點 | 148 °F |
| 精確質量 | 152.12000 |
| PSA | 17.07000 |
| LogP | 2.25760 |
| 外觀性狀 | 無色或近乎于無色液體帶有一種像薄荷醇的氣味 |
| 折射率 | n20/D 1.450 |
側柏(Platycladus orientalis(L.) Franco)屬于綠喬木,柏科植物,別名扁柏和片柏等,是我國的特產[5]。側柏壽命很長,常有百年和數百年以上的古樹。《本草綱目》將柏定義為“香木類上品”,《史記》更將柏定為“百木之長”。長在巖石或懸崖上的側柏(俗稱崖柏),由于營養(yǎng)貧瘠和環(huán)境惡劣,生長極其緩慢,上百年而常不盈尺,民間亦有“千年松、萬年柏”之說,主要分布在太行山脈、秦嶺山脈和大巴山脈等,其樹根、樹干具有木質密度高和油性大的特點,并有著醇厚的柏木香味。
據科學研究測試,側柏木所提取出揮發(fā)性的精油,在工業(yè)上廣泛用于木香型辛香型等的香精中和其他產品的增香劑,且具有排毒解毒、寧神舒筋和鎮(zhèn)痛抗菌等作用。據研究,側柏精油主要成分柏木腦(雪松醇)有活化作用,可作為血小板的活化因子(PAF)受體的拮抗劑,在炎癥反應中,人類的呼吸系統(tǒng)和心血管疾病等中發(fā)揮重要作用;其次,其還有鎮(zhèn)靜作用和解痙攣活性和調節(jié)心血管系統(tǒng)的作用[6]。最新研究還發(fā)現,雪松醇還有抗腫瘤活性抗癌的作用[7]。此外,側柏精油還具較強的抗蟻抗蟲作用[8]。由于側柏精油中還含有少量的沒藥醇,其具有多種生物活性,并且可以跟其它抗生素產生協(xié)同抗炎消炎作用。

精油的傳統(tǒng)生產工藝,一般采用的是加壓(壓榨)提取法或溶劑提取法[9]。但這些方法提取精油都需要花費較長的提取時間,且精油提取率不高、純度低,不符合現在工業(yè)生產的要求。超臨界流體萃取法(SCFE)是近30多年出現的一種新型的萃取分離技術,是以超臨界流體為溶劑,從固體或液體中萃取可溶組分的分離操作技術。其中,超臨界流體具有良好選擇性,其低粘度、高擴散系數等優(yōu)點,可以有效提高物質交換效率,超臨界萃取技術也是符合綠色化學原則的新型萃取技術[10]。其中,CO2作為一種理想的超臨界流體(無毒性、不可燃性和經濟性),已經廣泛利用于超臨界流體萃取植物精油的研究和生產中[11,12]。側柏精油擁有獨特的芳香味,并具有抗菌消炎、舒筋寧神和鎮(zhèn)靜陣痛等功效作用,可廣泛利用于各類香精香料、保健食品以及功效化妝品的研究開發(fā)中。側柏木的陳化時間對其精油的風味、含量、組成和功能等方面均具有重要影響,樹齡越老陳化時間越長的側柏木提取出的側柏精油得率更高、木香更純正濃郁、有效成分含量和功效也越高,可開發(fā)和利用的價值也越高,應是我們今后研究和開發(fā)的重點。
側柏酮的合成
1、六步全合成α-側柏酮和d6-α-側柏酮,容易獲得同位素標記的代謝物
歐盟再次允許生產含有側柏酮的產品,但已施加了最大限度的限制為了確保準確定量,評估這些產品是否滿足要求,以及為了更好地檢測微量的α-側柏酮及其主要代謝物,需要獲得同位素標記的衍生物。盡管Semmler在1900年就闡明了雙環(huán)單萜的結構,到目前為止,只有一個全合成的報道。Oppolzer等人利用一種溫和的鈀催化環(huán)化策略,從商業(yè)上可得的材料經過12個步驟制備了對映體富集的α-側柏酮。然而,這種方法不允許簡單地引入低廉的同位素標記。因此,Konrad Tiefenbacher等開發(fā)并描述了一種新穎的六步法獲得α-側柏酮,該方法可以從便宜的d6-丙酮中引入同位素標記。隨后合成的d6-側柏酮 1b也衍生化成最重要的代謝物3b、4b和5b。我們的合成策略是基于醇6a/6b的后期氧化(方案1),然后在位置C4進行區(qū)域選擇性和非對稱選擇性甲基化。這種方法似乎很有吸引力,因為醇6a/6b可以通過西蒙斯-史密斯環(huán)丙烷直接從環(huán)戊烯醇7a/7b中獲得環(huán)戊烯醇7a/7b可追溯到已知的由環(huán)戊二烯和丙酮合成的二甲基富烯8a和8b。因此,便宜的d6-丙酮可以作為同位素標記的來源。[13]
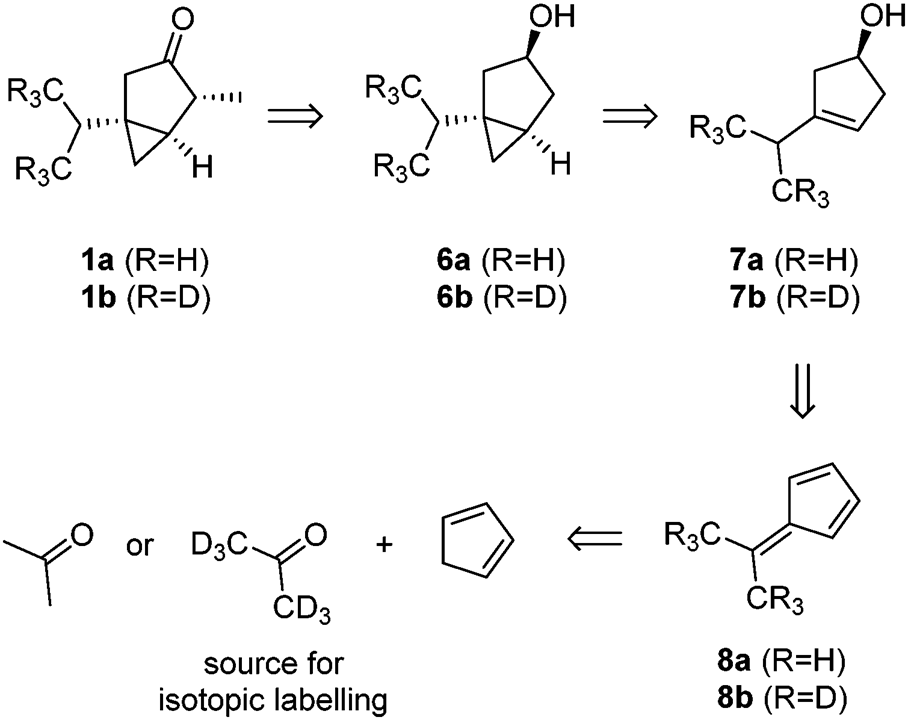
側柏酮 1a/1b的合成 [13]
2、在北美喬柏中提出的a-和b-側柏酮的生物合成
這一途徑中的第一個單萜類化合物是檜烯,它的形成是由檜烯合成酶(SS)催化的。檜烯已被證明是苦艾、艾菊和藥用鼠尾草(Karp和Croteau,1982年)中側柏酮的前體。這種酶被認為是鼠尾草化學類型進化的一個 "熱點"(Grausgruber-Gro¨ger等人,2012年)。在北美喬柏的檜烯合成酶應該是由一個單一的基因組位點調節(jié)(Foster等人, 2013)。后面的作者提議將其作為育種中標記輔助選擇的候選者,因為它作為側柏酮的前體具有基本的意義。雖然來自GPP前體的其他單萜的生物合成經常受到轉錄控制(Schmiderer等人,2010年;Xie等人,2008年),但在鼠尾草(S. officinalis)中,無法發(fā)現mRNA水平與檜烯最終產品之間的直接關聯(lián),這反映了更復雜的遺傳/代謝組調節(jié)(Grausgruber-Gro¨ger等人,2012)。從檜烯出發(fā),通過三個連續(xù)的步驟形成了側柏酮(下圖)。下一個生物合成步驟是,在裸子植物北美喬柏(Gesell等人,2015年)從檜烯到(+)-反式-香檜醇或在被子植物藥用鼠尾草從檜烯到(-)-順式-香檜醇(Karp和Croteau,1982年)。Gesell等人(2015年)確定CYP750B1和CYP76AA25是催化(+)-檜烯羥化為反式香檜-3-醇的酶。第一種酶的作用是至關重要的,它似乎具有強烈的底物特異性,而CYP76AA25具有更廣泛的底物譜,其轉錄譜與側柏酮的積累沒有很好的相關性(Gesell等人,2015)。早些時候,Karp和Croteau(1982年)認為(-)-順式-香檜醇是鼠尾草中同一途徑的中間體;然而,不知道艾蒿和其他物種的合成是通過反式還是順式香檜醇進行的。在一些論文中,反式香檜醇的存在已經被證明在苦艾精油中(Blagojevic′等人,2006年;Judzentiene和Budiene,2010年);因此,它可能是這里的一個中間物的候選產物。在香檜醇之后,只有檜酮的(+)異構體被提到是側柏酮生物合成的下一個中間體。它的形成是一個依賴NADPH和氧基因的羥基化過程。根據對鼠尾草和艾菊的調查,Dehal和Croteau(1987)認為,脫羥酶對 "底物組 "表現出相當程度的特異性。從檜酮開始,側柏酮的形成是一種依賴NADPH的立體選擇性還原。這種轉化的相應酶和不同的側柏酮異構體(α-或β-側柏酮)的形成,也還沒有得到澄清。根據參考文獻,一些物種只積累其中一種,而在其他植物中可能存在兩種異構體。[14]
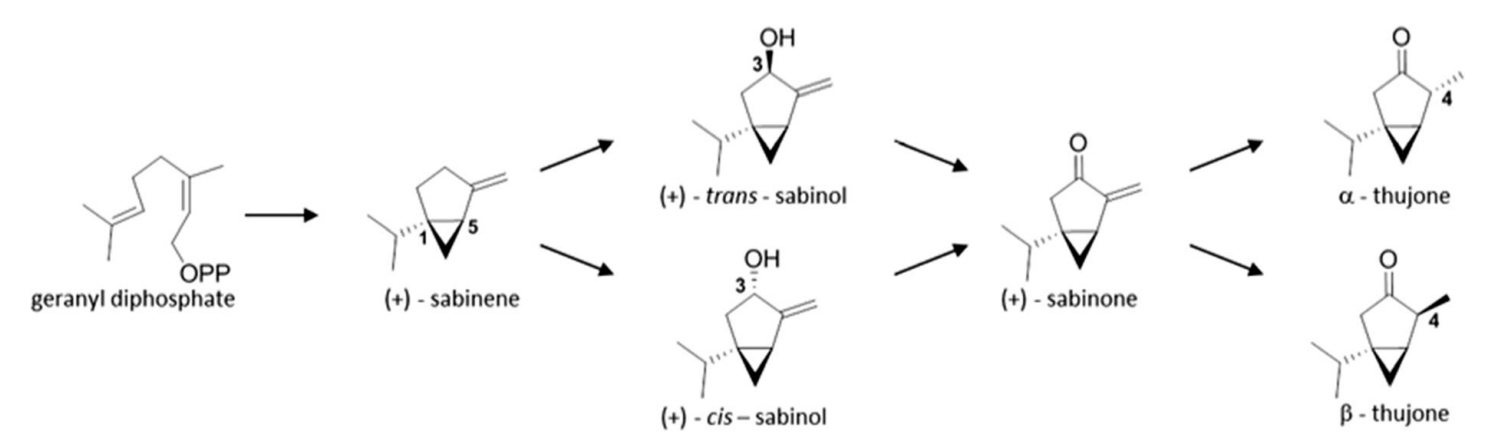
側柏酮的藥理活性
1、含有鼠尾草和艾草的食品和藥品中的側柏酮的風險評估--有證據表明需要進行監(jiān)管改革?
側柏酮是一種天然物質,通常用于食品和飲料中,存在于艾草和鼠尾草,以及草藥中。目前對食品中的側柏酮的限制是基于20世紀60年代的短期動物研究,這些研究為基于閾值的機制提供了證據,但只允許根據無觀測效應水平(NOEL)推導出可接受日攝入量(ADI)的初步數值。雖然2008年歐盟關于香原料的法規(guī)取消了對側柏酮的食品使用的管制,但歐洲藥品管理局在2009年對該物質進行了限制。本研究使用基準劑量(BMD)方法而不是NOEL來重新評估現有證據,并首次納入了國家毒理學計劃(NTP)的長期慢性毒性研究的數據。NTP的數據提供了與之前短期研究類似的結果。利用劑量反應模型,計算出雄性大鼠痙攣性發(fā)作的基準反應的BMDL下限(BMDL10)為11毫克/千克體重/天。在此基礎上,我們提出了0.11毫克/千克體重/天的每日允許攝入量,即使是高含量的含側柏酮食品(包括苦艾酒)的消費者也無法達到這一指標。雖然關于藥物中的側柏酮暴露的數據較少,但我們估計需要喝2至20杯艾草或鼠尾草茶才能達到這一ADI值,并認為這些草藥的短期藥用也可以被視為安全。總之,證據并不表明需要修改法規(guī),而是確認目前的限制對消費者有足夠的保護。[15]
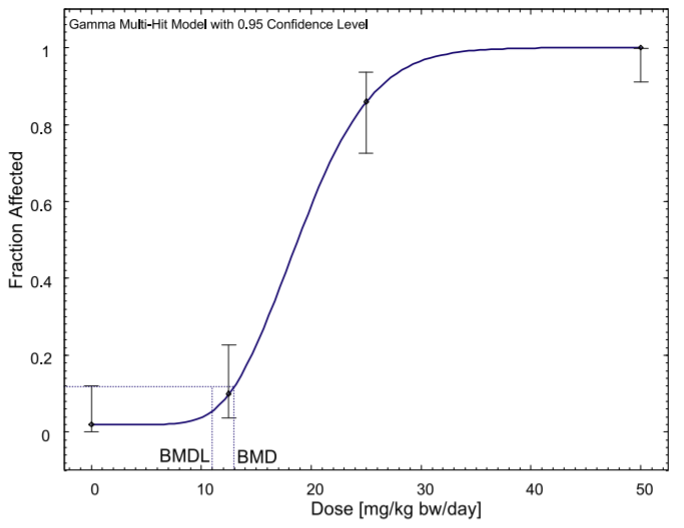
BMD模型對雄性B6C3F1大鼠痙攣發(fā)作的長期慢性研究。原始數據來自NTP(2009)。
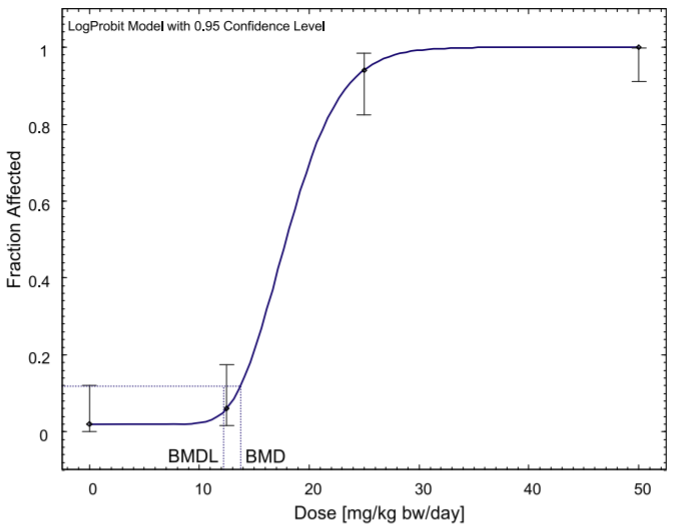
在一項對雌性B6C3F1大鼠的長期慢性研究中,建立BMD模型治療痙攣發(fā)作。原始數據來自NTP(2009)。
2、α,β-thujone通過代謝重編程和半胱氨酸蛋白水解酶依賴性凋亡在卵巢癌細胞中的治療潛力
α,β - 側柏酮通過半胱氨酸蛋白水解酶(caspase)依賴性凋亡降低卵巢癌細胞增殖并促進細胞死亡。此外,α,β - 側柏酮誘導線粒體去極化和鈣超載,導致代謝穩(wěn)態(tài)的破壞。α,β - 側柏酮 -觸發(fā)的細胞凋亡與內質網應激有關,內質網應激調節(jié)蛋白酶體活性,促進細胞死亡信號。最后,α,β - 側柏酮在ES2和OV90卵巢癌細胞系中與抗癌藥物順鉑協(xié)同作用,并通過致敏和改變細胞死亡模式提高其療效。綜上所述,Lee和Park的研究結果表明,α,β - 側柏酮,無論是單獨使用還是聯(lián)合使用,都可能有助于克服卵巢癌治療中使用的鉑基化療藥物的耐藥性。[16]
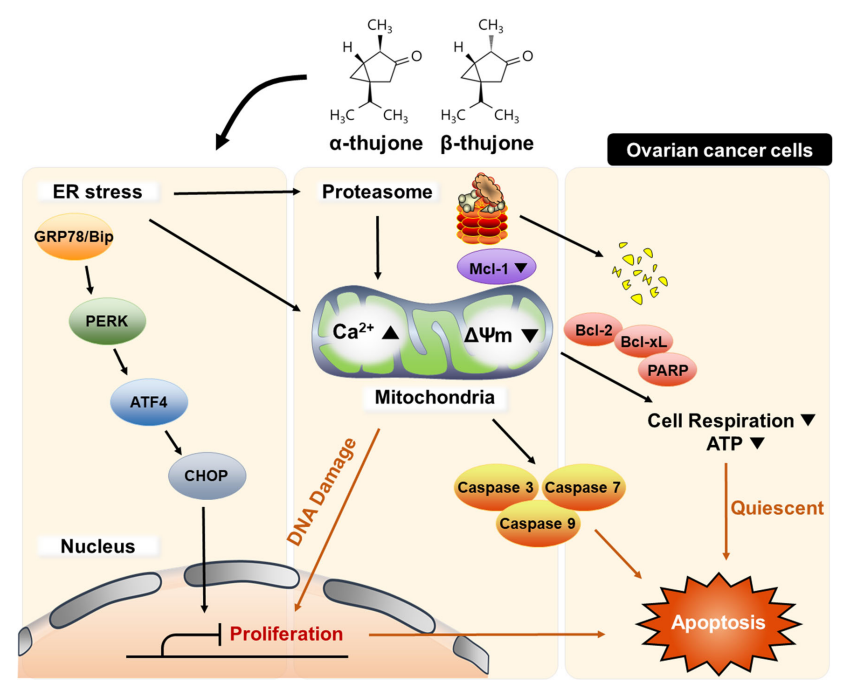
α,β - 側柏酮 -誘導的卵巢癌細胞的抗癌活性示意圖。三磷酸腺苷、三磷酸腺苷;ER,內質網[16]
3、體外人肝制劑中α-側柏酮的代謝研究
本研究旨在表征α-側柏酮在人肝臟制劑中的代謝特征,并確定細胞色素P450 (CYP)和其他可能催化α-側柏酮生物轉化的酶的作用。采用液相色譜-質譜(LC-MS)方法測定α-側柏酮和四種潛在代謝物,證明人肝微粒體產生兩種主要的(7-和4-羥基側柏酮)代謝物和兩種較小的(2-羥基側柏酮和香芹酚)代謝物。在人肝臟勻漿中檢測到谷胱甘肽和半胱氨酸偶聯(lián)物,但未定量。未檢測到葡萄糖醛酸或硫酸鹽綴合物。主要的羥基化作用占α-側柏酮微粒體主要代謝的90%以上。用CYP重組酶對α-側柏酮代謝進行篩選,發(fā)現CYP2A6主要參與7-和4-羥基化反應,而CYP3A4和CYP2B6參與的程度較低,CYP3A4和CYP2B6催化的2-羥基化反應較少。根據不同重組CYP酶的內在效率和這些酶在人肝微粒體中的平均豐度,計算出CYP2A6是人肝微粒體中最活躍的酶,平均負責70-80%的代謝。抑制篩選結果顯示,α-側柏酮對CYP2A6和CYP2B6均有抑制作用,50%的抑制濃度分別為15.4μM和17.5μM。[17]
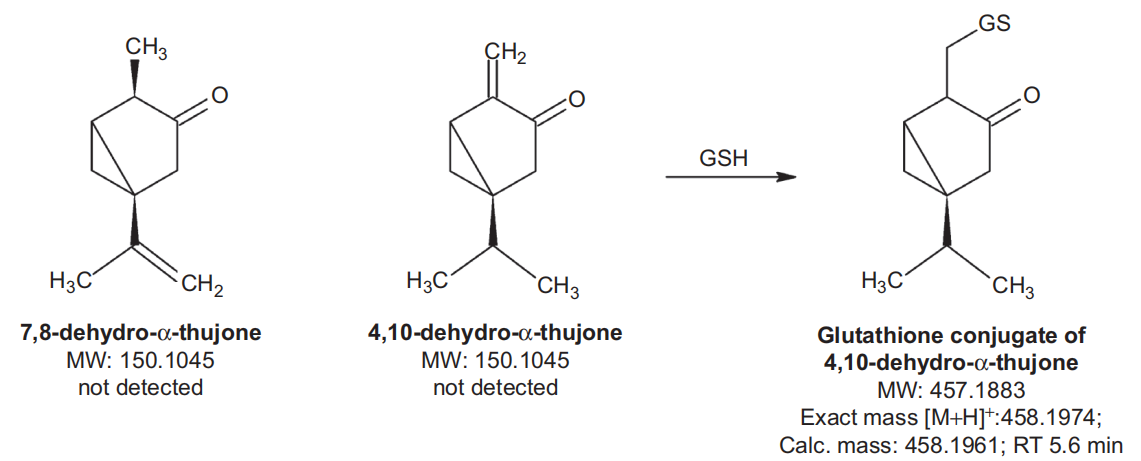
可能的α-側柏酮代謝產物的結構。說明了代謝產物的名稱、分子量(MW)、確切質量和保留時間(RT)[17]
4、苦艾酒:側柏酮影響下的注意力表現和情緒
這項研究的目的是確定苦艾酒對注意力表現和情緒的影響是否不同于那些只含有酒精的飲料。引起苦艾酒毒性的成分被認為是側柏酮。共有25名健康受試者參與了這項研究。我們使用了注意力表現測試和兩份不同情緒維度的問卷。他們提供了三杯酒,酒精含量相同,但側柏酮的含量不同。本研究結果表明,同時給藥含有高濃度側柏酮的酒精對注意力表現有負面影響。在此條件下,被試傾向于將注意力集中于中心注意域的信號,而忽略外圍注意域的信號;外周注意域正確反應次數顯著減少,反應時間和“誤報”反應次數顯著增加。這種影響在第一次測量時最為顯著。當受試者在酒精的影響下或同時被給予酒精和低濃度的側柏酮時,這些效應沒有被觀察到。情緒狀態(tài)維度的評估顯示酒精的抗焦慮作用被高的側柏酮濃度暫時抵消。由于它們顯然與酒精的作用相反,這里觀察到的反應可以用側柏酮對γ -氨基丁酸受體的拮抗作用來解釋。在其他的情緒狀態(tài)維度上也觀察到了類似的變化。[18]
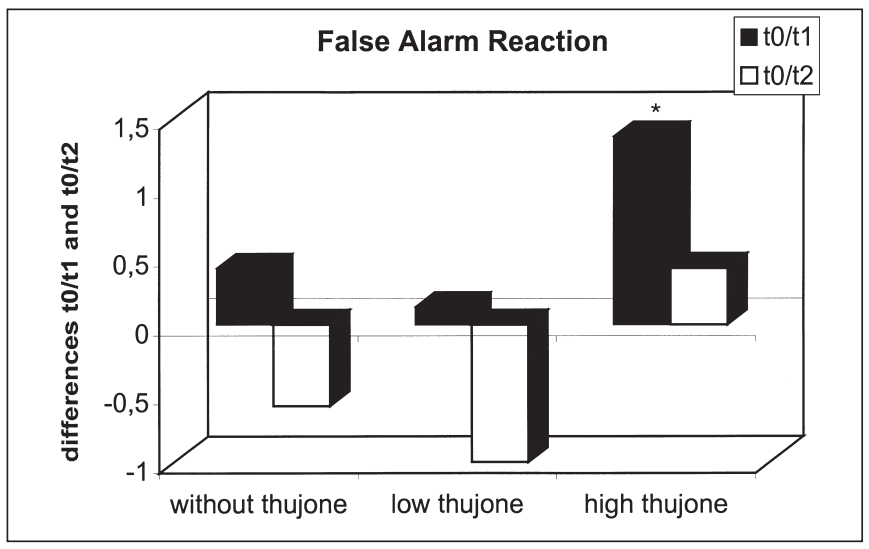
三種治療方法T0-T1 (T0-T2)誤報反應差異比較:酒精檢測陰性(T0)、酒精攝入后30分鐘(T1)、酒精攝入后90分鐘(T2)(*表示差異有統(tǒng)計學意義)
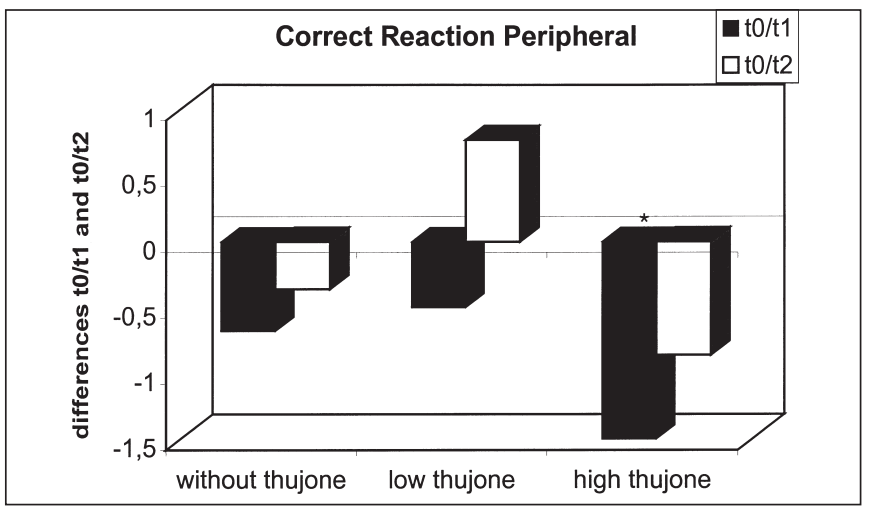
3個治療組T0-T1 (T0-T2)外周正確反應差異比較:酒精檢測陰性(T0)、酒精攝入后30分鐘(T1)、酒精攝入后90分鐘(T2)(*表示差異有統(tǒng)計學意義)
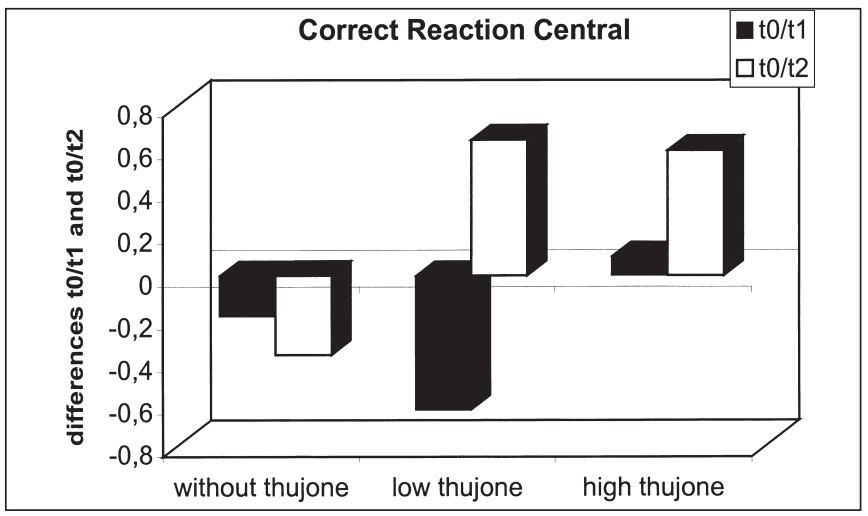
三種治療方法在T0-T1 (T0-T2)中樞正確反應的差異比較:酒精陰性(T0)、酒精攝入后30分鐘(T1)、酒精攝入后90分鐘(T2)
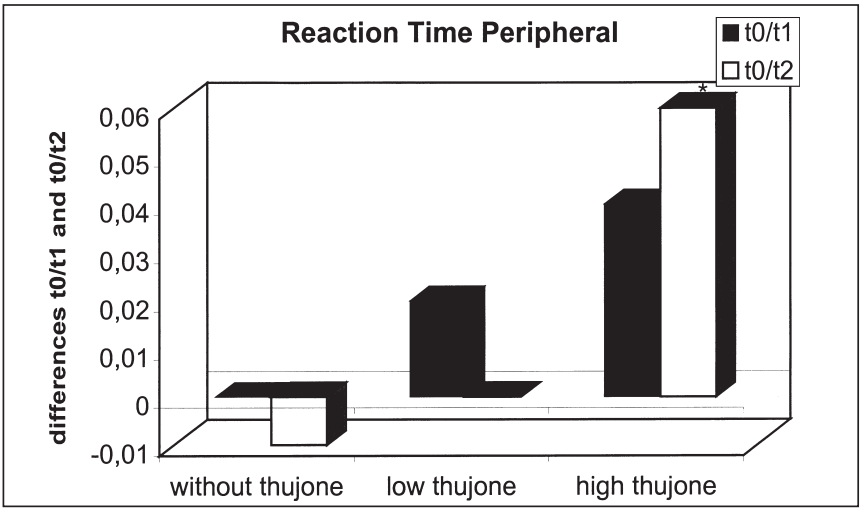
比較三種處理的T0- t1 (T0- t2)外周反應時間的差異:酒精檢測陰性(T0), 30
飲酒后分鐘(T1)、飲酒后90分鐘(T2)(*表示差異有統(tǒng)計學意義)
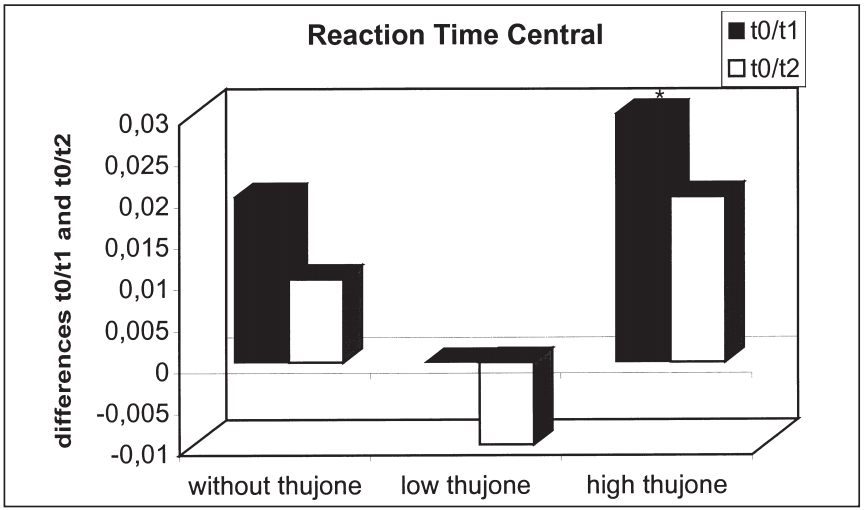
三種治療方法T0-T1 (T0-T2)中樞反應時間差異比較:酒精陰性(T0)、酒精攝入后30分鐘(T1)、酒精攝入后90分鐘(T2)(*表示差異有統(tǒng)計學意義)
參考文獻:
[1] https://zoelogic.pixnet.net/blog/post/47723454.
[2] https://zh.wikipedia.org/wiki/%E4%BE%A7%E6%9F%8F%E9%85%AE
[3]CN201811394406.7一種負氧離子納米凈醛噴劑
[4]CN201610417280.5一種基于香料閾值的木香香型煙用香精及其調配方法
[5] 回瑞華,侯冬巖,劉曉媛,等.不同方法提取側柏葉中揮發(fā)性成分的氣相色譜-質譜分析[J].質譜學報,2006,27(4):226-231
[6] 張巖,曲凡志,趙余慶.柏木醇的藥理作用研究進展[J].沈陽藥科大學學報,2014,31(7):584-588
[7] 蔣繼宏,李曉儲,高雪芹,等.側柏揮發(fā)油成分及抗腫瘤活性的研究[J].林業(yè)科學研究,2006,19(3):311-315
[8] 黃洛華,龍玲,陸熙嫻,等.側柏枝葉精油的化學組成與抗蟻性[J].林業(yè)科學研究,2001,14(4):416-420
[9] Kátia Andressa Santosa, Reinaldo Aparecido Bariccatti, Lúcio Cardozo-Filho, et al. Extraction of crambe seed oil using subcritical propane: Kinetics, characterization and modeling [J]. The Journal of Supercritical Fluids, 2015, 104: 54-61
[10] S M García-Abarrio, L Martin, J Burillo, et al. Supercritical fluid extraction of volatile oil from Lippia alba (Mill.) cultivated in Aragón (Spain) [J]. The Journal of Supercritical Fluids, 2014, 94: 206-211
[11] Edgar Uquiche, Natalia Cirano, Sonia Millao. Supercritical fluid extraction of essential oil from Leptocarpha rivularisusing CO2[J]. Industrial Crops and Products, 2015, 77: 307-314
[12] E Arranz, L Jaime, M C López de las Hazas, et al. Supercritical fluid extraction as an alternative process to obtain essential oils with anti-inflammatory properties from marjoram and sweet basil [J]. Industrial Crops and Products, 2015, 67: 121-129.
[13] Irene Thamm a, Johannes Richers b, Michael Rychlik a and Konrad Tiefenbacher. A six-step total synthesis of α-thujone and d6-α-thujone, enabling facile access to isotopically labelled metabolites. Chem. Commun., 2016, 52, 11701-11703. DOI: 10.1039/C6CC05376A
[14] Németh, éva & Thi Huong, Nguyen. (2020). Thujone, a widely debated volatile compound: What do we know about it?. Phytochemistry Reviews. 19. 10.1007/s11101-020-09671-y.
[15] Dirk W. Lachenmeier; Michael Uebelacker (2010). Risk assessment of thujone in foods and medicines containing sage and wormwood – Evidence for a need of regulatory changes?. Regulatory Toxicology and Pharmacology, 58(3), 437–443. doi:10.1016/j.yrtph.2010.08.012
[16] Lee, Jin-Young; Park, Hahyun; Lim, Whasun; Song, Gwonhwa (2020). Therapeutic potential of α,β thujone through metabolic reprogramming and caspase-dependent apoptosis in ovarian cancer cells. Journal of Cellular Physiology, 1-14. doi:10.1002/jcp.30086
[17] Abass, Khaled & Reponen, Petri & Mattila, Sampo & Pelkonen, Olavi. (2010). Metabolism of α-thujone in human hepatic preparations in vitro. Xenobiotica; the fate of foreign compounds in biological systems. 41. 101-11. 10.3109/00498254.2010.528066.
[18] Dettling, A & Gra?, Hildegard & Schuff, A & Skopp, Gisela & Strohbeck-Kühner, Peter & Haffner, H. (2004). Absinthe: Attention performance and mood under the influence of thujone. Journal of studies on alcohol. 65. 573-81. 10.15288/jsa.2004.65.573.