服務熱線
177-5061-9273

松樟酮—牛膝草的主要成分;異松樟酮是同分異構物,雖然兩者結構不太一樣,但是作用和特征和類似,都具有高神經毒性,更勝側柏酮。若是口服高濃度松樟酮,會引發神經抽搐、癲癇、心跳不規律、呼吸急促不規律、昏厥。因此,在使用上要更加小心。

| 中文名稱 | 松樟酮或松坎酮 | 異松樟酮或異松坎酮 |
| 英文名稱 | Pinocamphone | Iso-Pinocamphone |
| 精油來源 | 牛膝草 | 牛膝草 |
| 氣味描述 | 帶有一點樟腦以及針葉樹的香氣 | |
| 芳療功效 | 1 強力抗病毒(流感、HIV)、細菌(肺炎鏈球菌、金黃葡萄球菌),就像是細胞“守門員”一樣,把病源阻擋在門外2 抗黏膜發炎,消解黏液,改善氣管阻塞和久咳不愈 | |
| 心靈功效 | 強大的凈化能量,將身心的垃圾一掃而空 | |
| 注意事項 | 孕婦、嬰幼兒、癲癇患者禁用 | |
| 中文名稱 | 松樟酮 | ||
| CAS Number | 547-60-4 | 分子量 | 152.23300 |
| Density | N/A | Boiling Point | N/A |
| 分子式 | C10H16O | Melting Point | N/A |
| MSDS | N/A | Flash Point | N/A |
| 中文名稱 | 異松樟酮 | ||
| CAS Number | 18358-53-7 | 分子量 | 152.23300 |
| Density | N/A | Boiling Point | N/A |
| 分子式 | C10H16O | Melting Point | N/A |
| MSDS | N/A | Flash Point | N/A |

松樟酮的結構式

異松樟酮的結構式
相關文獻綜述
1、牛膝草的組成及生物活性研究進展
牛膝草(Hyssopus officinalis L. (Hyssop))是最受歡迎的草藥制劑之一,主要分布在東地中海至中亞地區。這種植物傳統上被用于藥用;一般來說,牛膝草的這些治療用途和健康益處在很大程度上是基于民間傳說而不是科學證實,這使得它成為一個很好的文獻收集對象,包括近期科學研究中可用的植物化學成分、體外實驗、動物模型和人體研究。從化學和生物學方面的研究表明,牛膝草的主要成分為黃酮類、芹菜素、槲皮素、大黃素、木犀草素及其甙類化合物,其次為綠原酸、原兒茶素、阿魏、丁香素、黃酮類化合物、對羥基苯甲酸和咖啡酸。從牛膝草地上部分提取的揮發油主要成分為萜類化合物松樟酮、異松樟酮和β-蒎烯。牛膝草對革蘭氏陽性和陰性細菌具有一定的抗氧化和抗菌活性,并具有抗真菌和殺蟲抗病毒特性。動物模型研究表明,該植物具有抑制肌松、抗血小板和α-葡萄糖苷酶的活性。然而,缺乏人體研究、不良反應和檢驗報告的牛膝草特性的臨床試驗,需要更多的關注以確定研究結果的生物學差異是否反映了不同的分離程序、使用的不同類型的植物材料、收集時間、地點或不同的化學型。[1]
2、陳年禁前苦艾酒中側柏酮、茴香酮和松樟酮的長期穩定性
為了確定對陳年苦艾酒樣品的分析是否代表其在20世紀初的原始成分,我們進行了研究。儲存在傳統的綠色玻璃瓶中的苦艾酒,在紫外線照射下長達200小時,其成分沒有變化。儲存在透明玻璃瓶中的樣品顯示出β-側柏酮含量減少了18%,同時出現了脫色現象。這些實驗表明,陳年苦艾酒中的側柏酮是穩定的,因為這些苦艾酒被儲存在綠色玻璃瓶中。被分析的禁前苦艾酒的保存顏色表明,在整個儲存期間沒有發生明顯的光照,因此間接證明沒有發生萜類物質的損失。通過對2001-2005年的樣品進行重新分析,進一步證明了苦艾酒的穩定性,截至2008年,這些樣品的側柏酮含量沒有變化。因此,以前對禁前苦艾酒的評估是有效的,并沒有受到隨著時間推移而出現的顯著的側柏酮降解的干擾。[2]
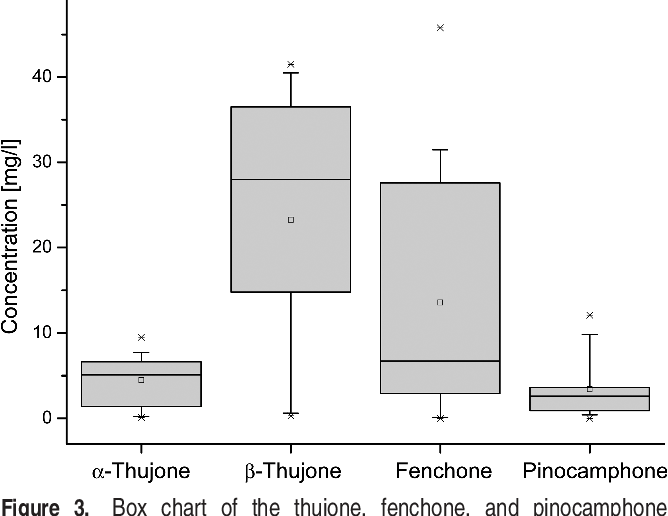
21個禁前年份苦艾酒樣品中側柏酮、茴香酮和松樟酮濃度的箱形圖[2]
3、陳年禁前苦艾酒的化學成分,特別關注側柏酮、茴香酮、松樟酮、甲醇、銅和銻的濃度
分析了13個禁前時代(即1915年之前)的苦艾酒樣品,這些樣品被認為是導致苦艾酒毒性的參數,包括自然產生的草藥精華(側柏酮、松樟酮、茴香酮)、甲醇、高級醇、銅和銻。研究發現,禁前苦艾酒的總側柏酮含量在0.5至48.3毫克/升之間,平均濃度為25.4 ± 20.3毫克/升,中值濃度為33.3毫克/升。作者的結論是,過去通常高估了禁前苦艾酒的側柏酮濃度。對禁前(1915-1988年)和現代商業苦艾酒(2003-2006年)的分析表明,所有苦艾酒的側柏酮范圍都很相似,從而推翻了禁前和現代根據歷史配方生產的苦艾酒之間存在根本區別的假設。松樟酮、茴香酮、基酒、銅和銻的分析都不明顯。綜上所述,除了乙醇之外,在苦艾酒中沒有發現任何能夠解釋 "苦艾酒 "中毒綜合征的物質。
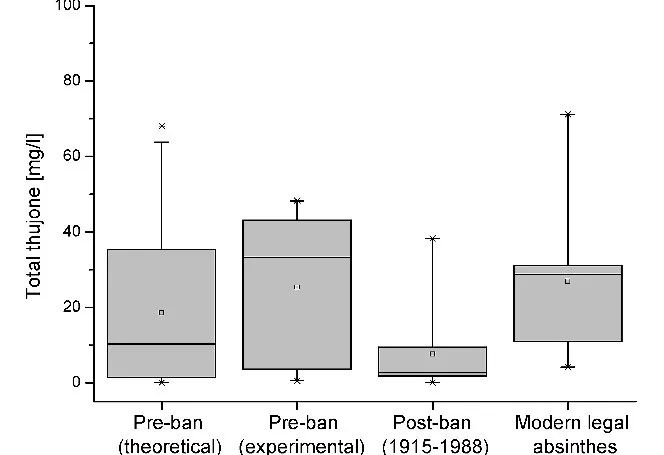
總側柏酮濃度的盒子圖。參考文獻3對“普通苦艾酒”的理論計算與禁酒前、禁酒后及現代法定苦艾酒的分析結果比較。[3]
4、牛膝草精油:其植物化學、生物活性和安全性的最新進展
神香草(Hyssopus)屬(又稱牛膝草)廣泛分布于中亞、東地中海和蒙古地區。它有六個主要品種,被用作草藥,如牛膝草(Hyssopus officinalis)被用作食品工業的調味品和香料。其他五個物種是H. ambiguus、H. cuspidatus、H. latilabiatus、H. macranthus和H. seravschanicus。它的種類被用于治療各種疾病,如感冒、咳嗽、食欲不振、真菌感染和痙攣狀況。它的成分,特別是精油,被普遍用作飲料、食品和化妝品的添加劑。揮發性成分被用于食品工業、化妝品工業和家用產品的芳香。其精油中的重要活性成分是β-蒎烯、松樟酮、異松樟酮和其他萜類化合物。神香草屬植物還與其他次級代謝產物聯系在一起,包括黃酮類化合物木犀草素、槲皮素、芹菜素及其葡萄糖苷,以及酚類化合物,包括阿魏酸、對羥基苯甲酸、原兒茶酸、綠原酸和咖啡酸。據報道,神香草的提取物具有潛在的抗病毒和抗真菌活性,這一點已在體外研究中得到證實,而體內調查則報告了神香草提取物在質膜松弛、細胞毒性和鎮靜作用中的關鍵作用。這種植物被認為在通常用于食品的水平上是相對安全的;盡管如此,還需要更多的研究來確定其安全狀況。[4]
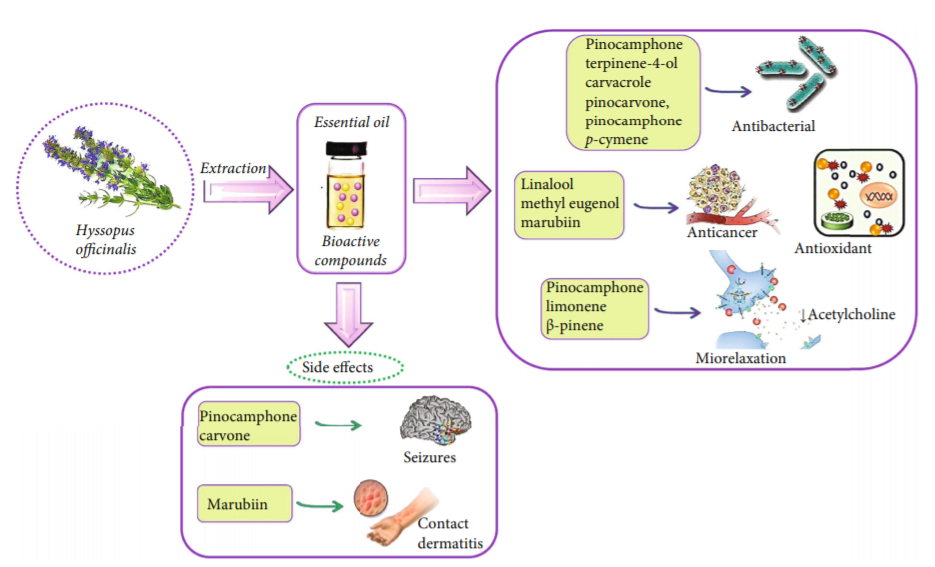
牛膝草精油的生物活性及其中分離的最具代表性的生物活性化合物的生物作用、副作用的相關示意圖。[4]
5、天氣條件對牛膝草精油品質的影響
本文是對諾維薩德田間和蔬菜作物研究所(塞爾維亞伏伊伏丁那省)三年(2017-2019年)種植的牛膝草(Hyssopus officinalis ssp. Officinalis)的化學成分的研究。此外,還調查了這些年與ISO標準的比較,以及精油中化合物保留指數的預測模型。通過水蒸汽蒸餾獲得的精油,通過GC-FID和GC-MS進行分析,是異松樟酮的化學類型。收集到的關于牛膝草(H. officinalis)的揮發性化合物的信息被用來對樣品進行分類,使用的是無平方根的聚類樹。根據GC-MS數據,應用相關分析來研究不同樣品的相似性。還采用了定量結構-保留指數關系(QSRR)來預測所鑒定的化合物的保留指數。共有74個通過實驗獲得的保留指數被用來建立預測模型。訓練周期的決定系數為0.910,表明該模型可用于預測牛膝草H. officinalis精油化合物的保留指數。
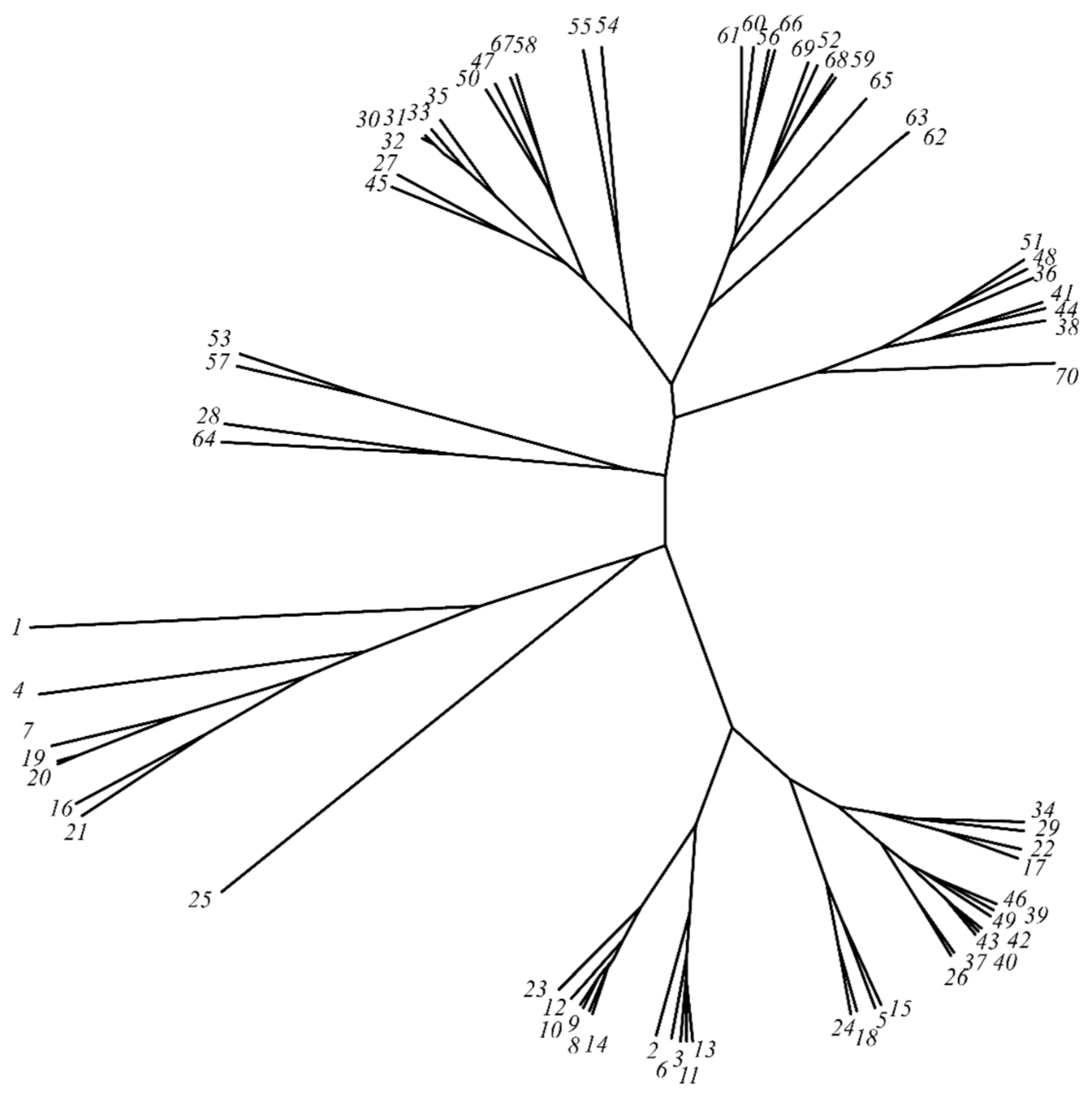
不同牛膝草樣品的無平方根聚類樹
根據無平方根的聚類樹,可以說有幾個化學類型。不過,它們主要含有不同比例的松樟酮+異松樟酮+β-蒎烯的混合物,但也作為一個特殊的化學類型出現。作為β-蒎烯化學類型,有β-蒎烯含量分別為19.3和24.7%兩個加入物(ssp. aristatus)被歸為一類。作為松樟酮化學類型,有松樟酮含量分別為34.0到58.3%的加入物歸為一類。然而,這遠遠超過了ISO 9841標準的要求(8.0至25.0)%。異松樟酮化學類型被分為幾個亞組。含有33.6%和44.7%的化學型(滿足ISO 9841標準的要求),但只有兩個樣品含有足夠的松樟酮(14.1%),而另外兩個樣品含有松香芹酮和檸檬烯,以及β-蒎烯等重要化合物。此外,除了兩個異松樟酮含量較高的品種外,異松樟酮的化學類型為(24.9至58.3)%,符合ISO 9841標準對該化合物的要求。含量在16.3和21.1%之間的樣品也滿足ISO 9841標準的要求。然而,在其他樣品中,其他的主要化合物是1,8-桉樹腦、β-蒎烯和樟腦。極其豐富的異松香酮化學類型,有(58.5至72.8)%(加入物描述的異松香酮含量遠高于ISO 9841標準的要求(25.0至45.0)%。獲得的數據確定了樣品在因子平面上的位置。幾何學上接近的點表明這些點所代表的模式是相似的。三組混合化學類型的松樟酮+異松樟酮+β-蒎烯大多符合ISO 9841標準中的精油質量要求。除了這四個主要的化學型,還有松香芹酮、1,8-桉樹腦、檸檬烯+甲基丁香酚、芳樟醇、百里香酚,以及有一個加入的化學型:α-蒎烯和乙酸甲酯。這些不同的牛膝草H. officinalis樣品之間的相關性顯示在下圖。[5]

不同牛膝草標本間的相關性。進行相關分析是為了研究不同的牛膝草Hyssopus officinalis樣品(1-70)的活性化合物含量的相似性,其結果直觀地顯示在上圖。從圖中可以看出,顯示兩個樣品關系的方塊的藍色越深,說明這些樣品之間的相關性越強,也就是說,活性化合物含量的相似性越明顯。另一方面,較淺的色調表明樣品之間有一定的不相似性。因此,如果色調較淺,相關性就較低。[5]
6、牛膝草精油對離體腸制劑的肌肉松弛作用
研究了牛膝草Hyssopus officinalis L. (Lamiaceae)的精油及其一些主要成分(異松樟酮、檸檬烯和β-蒎烯)對豚鼠和兔子腸道的分離制劑的肌肉松弛活性。精油和異松樟酮以濃度依賴的方式抑制了乙酰膽堿和BaCl2誘導的豚鼠回腸收縮(對乙酰膽堿的IC50為42.4μg/ml和61.9μg/ml;對BaCl2為48.3μg/ml和70.4μg/ml),而檸檬烯或β-蒎烯使組織收縮沒有變化。在豚鼠回腸中,牛膝草H. officinalis精油也阻止了由CaCl2引起的收縮。在離體兔空腸中,精油降低了自發運動的幅度,并降低了肌肉回縮的發生;血紅蛋白、亞甲基藍、N ω-硝基-L-精氨酸甲酯(L-NAME)或普萘洛爾都不能阻止肌松作用。[6]
胃腸動力障礙疾病(disorder of gastrointestinal motility, DGIM)嚴重影響人類的生活質量, 是世界各地常見的公共健康問題, 其發病機制與胃腸動力紊亂和腸內分泌細胞分泌的胃腸激素水平失衡密切相關. 眾所周知, 便秘和消化不良是臨床最常見的胃腸動力障礙疾病. 大量調查顯示, 消化不良影響5%-10%的人, 而我國的功能性便秘的患病率約為3.1%-25.92%. 胃腸動力是指胃腸道肌肉的收縮和蠕動能力, 包括胃腸道肌肉收縮的頻率和力量, 是維持胃腸道正常生理功能的關鍵組成部分. 胃腸動力功能紊亂是導致DGIM的主要因素之一, 在胃腸病門診患者中胃腸動力障礙患者占40%以上, 且影響了總人口的20%以上. 目前, 在我國胃腸動力障礙性疾病的發病率非常高, 并且已成為消化內科的重點研究對象. 隨著現代醫學對DGIM的深入研究, 發現胃腸動力調節機制的復雜性(下圖), 它是在中樞神經系統(central nervous system, CNS)的調節和控制下, 由自主神經系統、腸神經系統(enteric nervous system, ENS)和平滑肌細胞等相互調控來完成胃腸道的正常節律性運動. ENS主要由肌間神經叢和黏膜下神經叢組成, 位于縱向平滑肌和橫向平滑肌層之間的肌間神經叢, 并參與平滑肌收縮的啟動和控制, 對胃腸運動的調節起著至關重要的作用. 近年來許多研究表明, ENS、Cajal間質細胞(interstitial cells of Cajal, ICCs)、平滑肌細胞(smooth muscle cells, SMCs)構成一個網絡體系, 參與胃腸動力的調節。[7]
胃腸動力功能障礙疾病是臨床上常見的疾病, 它的發病率高, 嚴重影響患者的生活質量. 治療此類疾病的關鍵在于恢復正常的胃腸動力功能. 胃腸動力是一種非常復雜的神經肌肉活動, 它能維持人體正常消化功能, 任何影響胃腸道節律性運動的因素都會引起各種DGIM. 目前, 對胃腸動力調節機制方面的實驗研究已經廣泛開展. 腸神經系統作為機體的第二大腦, 在胃腸動力調節中起著重要的作用. 它能與中樞神經系統雙向聯系, 調控胃腸動力. 腸神經系統與腸內大部分細胞都有關系, 它能釋放神經遞質或胃腸激素調節Cajal間質細胞和平滑肌細胞的活性. 目前, 對于胃腸動力調節機制的研究大部分集中在CNS、ENS、自主神經、Cajal間質細胞及腦腸肽還有一些離子通道等方面. 近年來, 對苦味及其受體在消化道系統的研究也越來越多, 并且發現苦味能調節胃腸蠕動, 其機制可能是直接通過苦味受體發揮作用, 或通過調節胃腸激素和神經遞質來影響胃腸動力. 這可能是一種新的治療胃腸動力障礙疾病的靶點. 深入研究胃腸動力及其調節機制, 為治療胃腸動力障礙疾病提供更有效的藥物和方法, 這對促進人類健康有著重要的意義.[7]
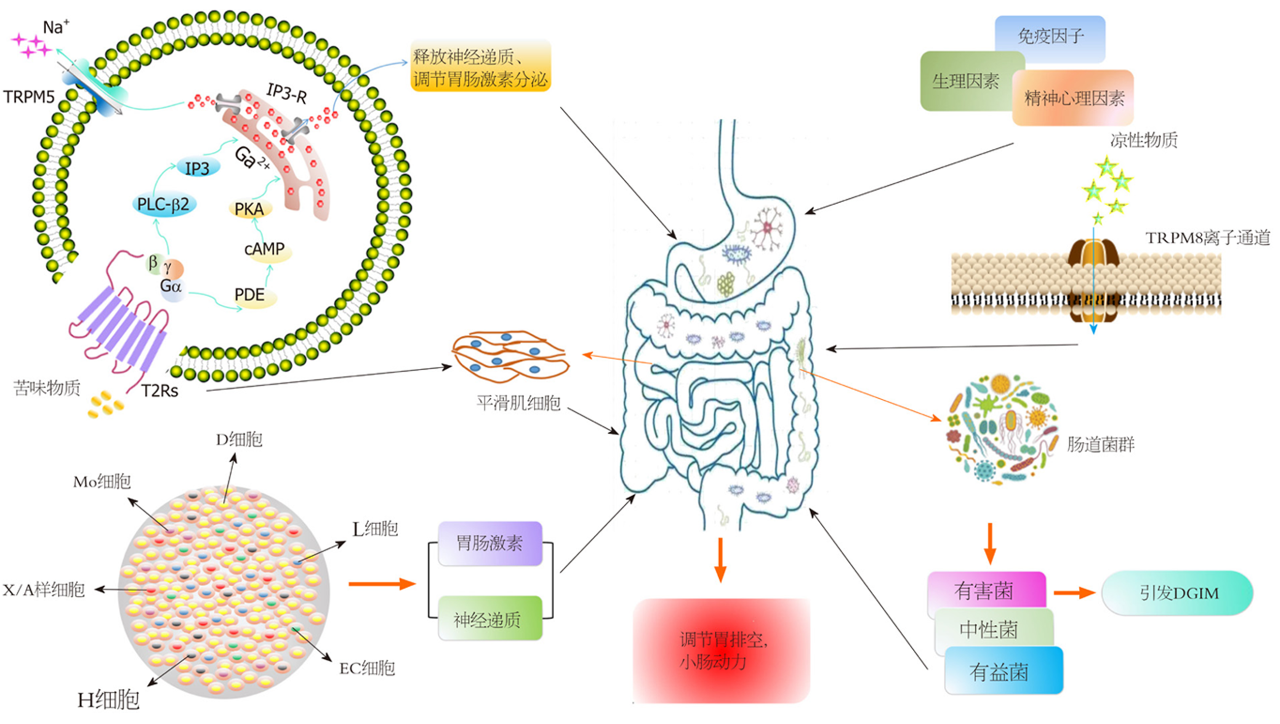
胃腸動力調節機制示意圖. TRPM5: 瞬時受體電位通道M5; T2Rs: 苦味受體; PLC-β2: 磷脂酶Cβ2; IP3: 肌醇1,4,5-三磷酸; IP3-R: 肌醇1,4,5-三磷酸受體; PKA: 蛋白激酶A; cAMP: 環磷酸腺苷; PDE: 磷酸二酯酶; TRPM8: 瞬時受體電位通道M8; DGIM: 胃腸動力障礙疾病.[7]
參考文獻
[1] Fathiazad, Fatemeh and Sanaz Hamedeyazdan. “A review on Hyssopus officinalis L.: Composition and biological activities.” African Journal of Pharmacy and Pharmacology 5 (2011): 1959-1966.
[2] Lachenmeier, Dirk W., David Nathan-Maister, Theodore A Breaux and Thomas Kuballa. “Long-term stability of thujone, fenchone, and pinocamphone in vintage preban absinthe.” Journal of agricultural and food chemistry 57 7 (2009): 2782-5 .
[3] Lachenmeier, Dirk W., David Nathan-Maister, Theodore A Breaux, Eva-Maria Sohnius, Kerstin Schoeberl and Thomas Kuballa. “Chemical composition of vintage preban absinthe with special reference to thujone, fenchone, pinocamphone, methanol, copper, and antimony concentrations.” Journal of agricultural and food chemistry 56 9 (2008): 3073-81.
[4] Javad Sharifi-Rad, Cristina Quispe,Manoj Kumar, Muhammad Akram, Mewish Amin, et al. Hyssopus Essential Oil: An Update of Its Phytochemistry, Biological Activities, and Safety Profile. Oxidative Medicine and Cellular Longevity, 2022, ArticleID 8442734. https://doi.org/ 10. 1155 /2022/8442734.
[5] A?imovi? M, Pezo L, Zeremski T, Lon?ar B, Marjanovi? Jeromela A, Stankovi? Jeremic J, Cvetkovi? M, Sikora V, Ignjatov M. Weather Conditions Influence on Hyssop Essential Oil Quality. Processes. 2021; 9(7):1152. https://doi.org/10.3390/pr9071152
[6] Mei Lu, Lucia Battinelli, Claudia Daniele, Cristiana Melchioni, Giuseppe Salvatore, Gabriela Mazzanti. Muscle Relaxing Activity of Hyssopus officinalis Essential Oil on Isolated Intestinal Preparations. Planta Medica, 2002, 68(3): 213-216. doi: 10.1055/s-2002-23139.
[7] 于紅珍, 付明海, 吉小平, 額尼榮貴. 簡述胃腸動力調節機制的研究進展. 世界華人消化雜志 2020; 28(23): 1183-1191 [DOI: 10.11569/wcjd.v28.i23.1183]