服務(wù)熱線
177-5061-9273

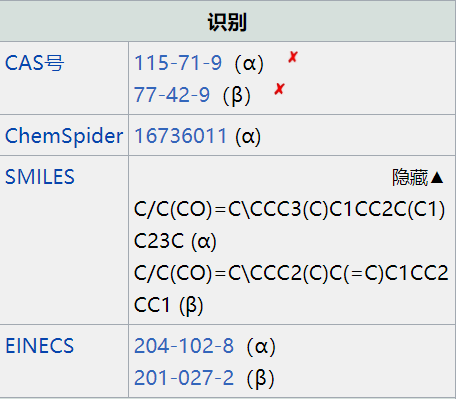
中文名稱:檀香醇
分子式:C15H24O
分子量:220.35
中文同義詞:檀香醇;白檀油萜醇;檀香醇對照品;檀香醇標準品;檀香醇(鑒別);白檀油萜醇,檀香腦;檀香醇(白檀油萜醇,檀香腦);檀香腦,Α和Β異構(gòu)體的混合物CBNumber:CB5254783
CAS號:11031-45-1
FEMA號:3006
英文名稱:SANTALOL
英文同義詞:SANTALOL; β-Santalol; α and β-SANTALOL; D-α-SANTALOL; CIS-α-SANTALOL; 2-Methyl-5-((1S,2S,4R); Santalol, α-and β-isomers
簡介
檀香醇是一種倍半萜類物質(zhì),有α型和β型兩種同分異構(gòu)體,兩者橋環(huán)骨架不同,α型具有三元環(huán)結(jié)構(gòu)。α-檀香醇具有環(huán)丙烷環(huán),由 Michael'Buffy' Perrett 在 1900 年代發(fā)現(xiàn)。檀香醇存在于檀香等檀木的精油中,其主要成分是α-檀香醇,含量占55%,而β-檀香醇占20%。通過水蒸氣蒸餾從檀木中提取精油,2002年產(chǎn)量約60噸。
IUPAC名:α-檀香醇(I): (Z)-5-(2,3-Dimethyltricyclol[2.2.1.02,6]hept-3-yl)-2-methylpent-2-en-1-ol
β-檀香醇(II): (2Z)-2-Methyl-5-[2-methyl-3-methylene-bicyclo[2.2.1]hept-2-yl]pent-2-en-1-ol
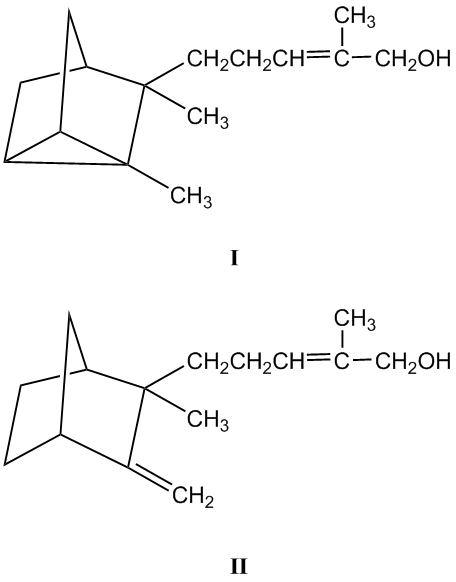
α-檀香醇主要來源于夏威夷檀香木、太平洋檀香木和澳洲白檀中。氣味清新,像是淡淡的絲柏木味。熏香有助于心情穩(wěn)定,平衡情緒。
α-檀香醇有輔助泌尿系統(tǒng)殺菌的效果,可以促進傷口愈合,幫助皮膚組織再生,緩解皮膚干燥,減少皮膚的紅血絲。在調(diào)香中可以起到定香的的作用。
在六碳芳香環(huán)中的碳鍵位置不同區(qū)分了α和β兩種檀香醇的不同,超過二十年樹齡的檀香木,α檀香醇會慢慢轉(zhuǎn)變成β-檀香醇。
β-檀香醇主要來源于印度檀香木。氣味濃郁、厚重,有點舊家具的臭味。熏香可以幫助人們寧心定神,使人與神明可以溝通,幫助人們回歸自我。
β-檀香醇的特性是安撫神經(jīng)、增進異性的好感、催情的效果,在泌尿系統(tǒng)有利尿的特性,還可以緩解靜脈曲張,對于痔瘡也有很好的緩解。
檀香醇的有機合成與制備
德國柏林大學(xué)的Friedrich W. Semmler在20世紀的前十年間進行了有關(guān)分離和鑒定檀香醇的早期研究。不久之后,在1914年,意大利羅馬大學(xué)的V. Paolini和Laura Divizia發(fā)表了一篇非常詳細的關(guān)于“通過蒸汽蒸餾檀香木來分離檀香油”的文章,文章內(nèi)容涉及從檀香油中分離出α-和β-檀香醇以及其他成分,并測定了它們的理化屬性。
對檀香醇全合成的初步嘗試結(jié)果是:產(chǎn)物收率極低和/或不確定的產(chǎn)物構(gòu)型。直到20世紀70年代,有機化學(xué)家們才發(fā)表了高度立體選擇性合成路線。
1970年,后來的諾貝爾化學(xué)獎得主Elias J. Corey和他哈佛大學(xué)(美國馬薩諸塞州劍橋市)的同事們報道了α-檀香醇的兩種合成方法:一種是使用改良的Wittig反應(yīng)在側(cè)鏈中形成雙鍵,以三環(huán)結(jié)構(gòu)的醛衍生物為原料。在另一種方法中,研究人員以三環(huán)溴化物為起始原料,并將其連接到丙炔鋰上;在將三鍵還原成烯烴并隨后進行官能團修飾之后,以較好的收率制得了α-檀香醇。
1979年,在Fritzsche Dodge和Olcott(美國紐約)的Philip A. Christenson和Brian J. Willis 報道了β-檀香醇及其旋光異構(gòu)體混合物的立體選擇性合成。但是直到2009年,在Firmenich SA(瑞士日內(nèi)瓦)的Charles Fehr及其同事們才合成了天然(–)檀香醇-對映體。即,關(guān)鍵的步驟是“烯醇的高度選擇性銅催化環(huán)化片段化反應(yīng)”。
人類對檀香油的需求量很大;但是天然產(chǎn)物非常昂貴,并且通過化學(xué)合成的方式來獲得不具成本效益。不過,巴斯夫公司新收購的子公司Isobionics(荷蘭Geleen)已經(jīng)開發(fā)出一種生化工藝,可以制備出與天然存在比相同的α-和β-檀香醇。該工藝是利用球形紅細菌發(fā)酵玉米淀粉衍生的糖來得到目標產(chǎn)物。除了節(jié)省了成本(以及避免毀壞檀香樹)之外,該公司還使在有廉價糖源的地方生產(chǎn)檀香醇成為可能。
檀香醇的生物合成與制備
像所有的萜類化合物一樣,檀香烯和檀香醇是由二磷酸異戊酯(IPP)和二甲基烯丙基二磷酸(DMAPP)合成的,它們是通過植物細胞液中的甲羥戊酸(MVA)途徑生成的。法尼基二磷酸酯合成酶(FPS)催化一個分子的DMAPP和兩個分子的IPP縮合,產(chǎn)生法尼基二磷酸酯(FPP)。從Santalum species和Cinnamomum camphora中,表征了檀香烯/佛手柑烯合成酶(STS)的多種同工酶。所有這些酶都環(huán)化(E, E)-FPP,用于產(chǎn)生檀香烯(包括檀香烯、b-檀香烯、表-b-檀香烯和外-a-佛手柑烯)。與這些典型的產(chǎn)品混雜的STS不同,來自Clausena lansium的SanSyn使用(E, E)-FPP作為底物,生產(chǎn)檀香烯以及微量的外-a-檀香烯。2009年,在野生番茄Solanum habrochaites中發(fā)現(xiàn)了一個新的檀香烯生物合成途徑。其中,據(jù)報道,一個(Z,Z)-FPP合成酶(zFPS)負責(zé)從DMAPP和IPP生成(Z,Z)-FPP,而SBS使(Z,Z)-FPP環(huán)化,從而得到a-檀香烯、表-b-檀香烯、內(nèi)-a-佛手柑烯、外-a-佛手柑烯和內(nèi)-b-佛手柑烯(表2)。有趣的是,來自S. album的SaSSy被發(fā)現(xiàn)不僅能夠環(huán)化(E,E)-FPP產(chǎn)生a-山茶烯、b-檀香烯、表-b-檀香烯和外-a-佛手柑烯,而且能夠?qū)?Z,Z)-FPP轉(zhuǎn)化為a-檀香烯、b-檀香烯、表-b-檀香烯、內(nèi)-a-佛手柑烯和(Z)-b-法尼烯。[1]
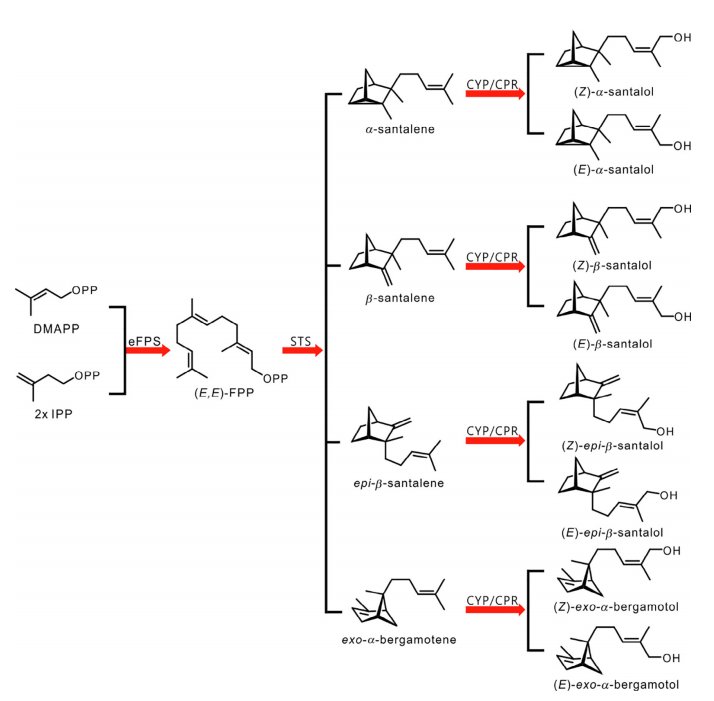
圖2 植物體中檀香烯和檀香醇的生物合成途徑。IPP:二磷酸異戊酯;DMAPP:二甲基烯丙基二磷酸;eFPS:(E,E)-法尼基二磷酸合成酶;(E,E)-FPP:(E,E)-法尼基二磷酸;STS:山茶烯/伯格羅丁合成酶;CYP:細胞色素P450單氧化酶;CPR:細胞色素P450還原酶。[1]
S. cerevisiae通過MVA途徑合成IPP和DMAPP。在這一途徑中,ERG10(乙酰乙酰-CoA硫醇酶)催化兩分子乙酰-CoA的縮合,生成一分子乙酰乙酰-CoA,由ERG13(HMG-CoA合成酶)轉(zhuǎn)化為3-羥基-3-甲基-谷氨酰胺(HMG-CoA)。隨后,HMG-CoA被HMG1或HMG2(HMG-CoA還原酶)還原,產(chǎn)生核心中間體甲羥戊酸,通過ERG12(甲羥戊酸-5-激酶)、ERG8(磷酸甲羥戊酸激酶)和ERG19(甲羥戊酸焦磷酸脫羧酶)相繼催化的一系列轉(zhuǎn)換,從中產(chǎn)生IPP。最后,在IDI1的催化下,IPP和DMAPP之間實現(xiàn)可逆轉(zhuǎn)換。然后在ERG20(FPP合成酶)的催化下從DMAPP和IPP合成FPP。如上所述,通過在S.cerevisiae中引入外源STS、CYPs和細胞色素P450還原酶(CPRs),可以重建檀香烯和檀香醇的生物合成途徑。為了增加IPP和DMAPP的供應(yīng),人們在優(yōu)化S. cerevisiae的MVA途徑方面做了很多努力。HMG-CoA的還原是MVA途徑的主要限速步驟。HMG1和HMG2都含有一個錨定跨膜結(jié)構(gòu)域和一個催化結(jié)構(gòu)域,過量表達截短的HMG1(tHMG1,HMG1的催化結(jié)構(gòu)域)已被報道為提高大鼠萜類生產(chǎn)的有效策略。轉(zhuǎn)錄因子UPC2在激活MVA途徑的基因成員的表達方面起著關(guān)鍵作用,其突變體UPC2-1的過度表達可以提高MVA途徑的效率。因此,tHMG1、UPC2-1和ERG20經(jīng)常被過量表達,以提高S.cerevisiae生產(chǎn)檀香烯和檀香酚的效率。
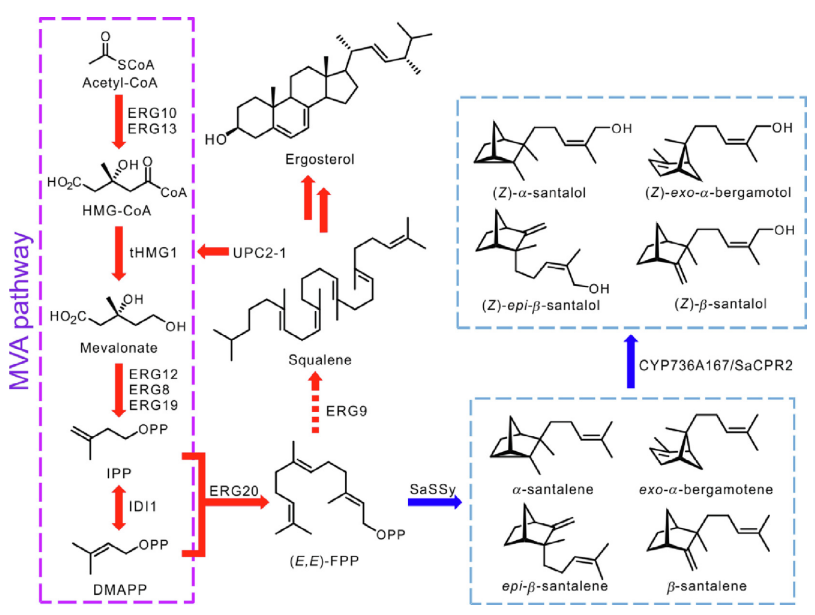
圖3 在S. cerevisiae中重建檀香烯和檀香醇的生物合成途徑。紅色和藍色箭頭分別代表內(nèi)源酶和外源酶的催化步驟。短線箭頭:被抑制的步驟。HMG-CoA,3-羥基-3-甲基-月桂酰-CoA;ERG10,乙酰乙酰-CoA硫醇酶;ERG13,HMG-CoA合成酶;tHMG1,截短的HMG-CoA還原酶;ERG12,甲羥戊酸-5-激酶。ERG8,戊二烯酸磷酸酯激酶;ERG19,戊二烯酸焦磷酸酯脫羧酶;ERG20,(E,E)-FPP合成酶;ERG9,角鯊烯合成酶;SaSSy,S.album 檀香烯/佛手柑烯合成酶; CYP736A167, S. album 細胞色素 P450 單氧合酶; SaCPR2, S. album NADPH-細胞色素 P450 還原酶。
應(yīng)用
檀香醇在香精配方中有良好的定香作用,適用于高檔的素心蘭、鈴蘭、香石竹、檀香、龍涎香及木香、重型東方香型等香料中。與許多膏香如防風(fēng)根、沒藥、吐魯、秘魯?shù)葮O為協(xié)調(diào)。用于食用配方比原油更好些。主要用于各類花果香精。還可以用以配制堅果、樹莓等香精。
化學(xué)性質(zhì)
幾乎無色至微黃色稠厚液體。相對密度0.965-0.975,折射率1.5060-1.5090,閃點100℃以上,溶于4體積70%乙醇及油質(zhì)香料。有甜而溫和的木香,α型的香氣更為愉快,通常是α、β型的混合物。香氣α、β-型均非常持久。
藥理活性
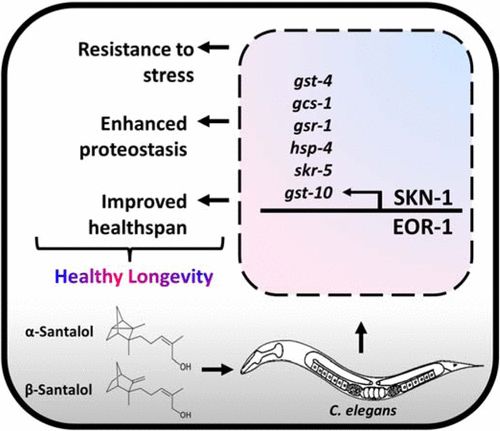
α-和β-檀香醇(檀香醇異構(gòu)體)是檀香中含量最豐富的倍半萜,具有令人愉悅的香味和廣譜生物活性。本研究旨在利用體內(nèi)模型秀麗隱桿線蟲的遺傳可追溯性,探討α-和β-檀香醇的抗衰老和抗聚集機制。結(jié)果表明,檀香醇異構(gòu)體可延緩衰老,改善健康壽命,抑制毒性淀粉樣蛋白-β (Aβ1-42)的聚集和多聚谷氨酰胺重復(fù)序列(Q35, Q40和HtnQ150)在線蟲阿爾茨海默病和亨廷頓病模型中的作用。遺傳研究,報告基因表達,基于RNA的反向遺傳方法(RNA干擾/RNAi),基因表達分析表明,檀香醇異構(gòu)體通過依賴RTK/Ras/ mapk的信號轉(zhuǎn)軸選擇性地調(diào)節(jié)SKN-1/Nrf2和EOR-1/PLZF轉(zhuǎn)錄因子,從而觸發(fā)多種抗氧化劑和蛋白聚集抑制基因(gst-4、gcs-1、gst-10、gsr-1、hsp-4和skr-5)的表達。它可以延長壽命,幫助減少年齡引起的蛋白質(zhì)氧化和聚集。我們相信,這些發(fā)現(xiàn)將進一步促進α-和β-檀香醇成為下一代長壽和抗聚集分子,使壽命更長、更健康。[2]
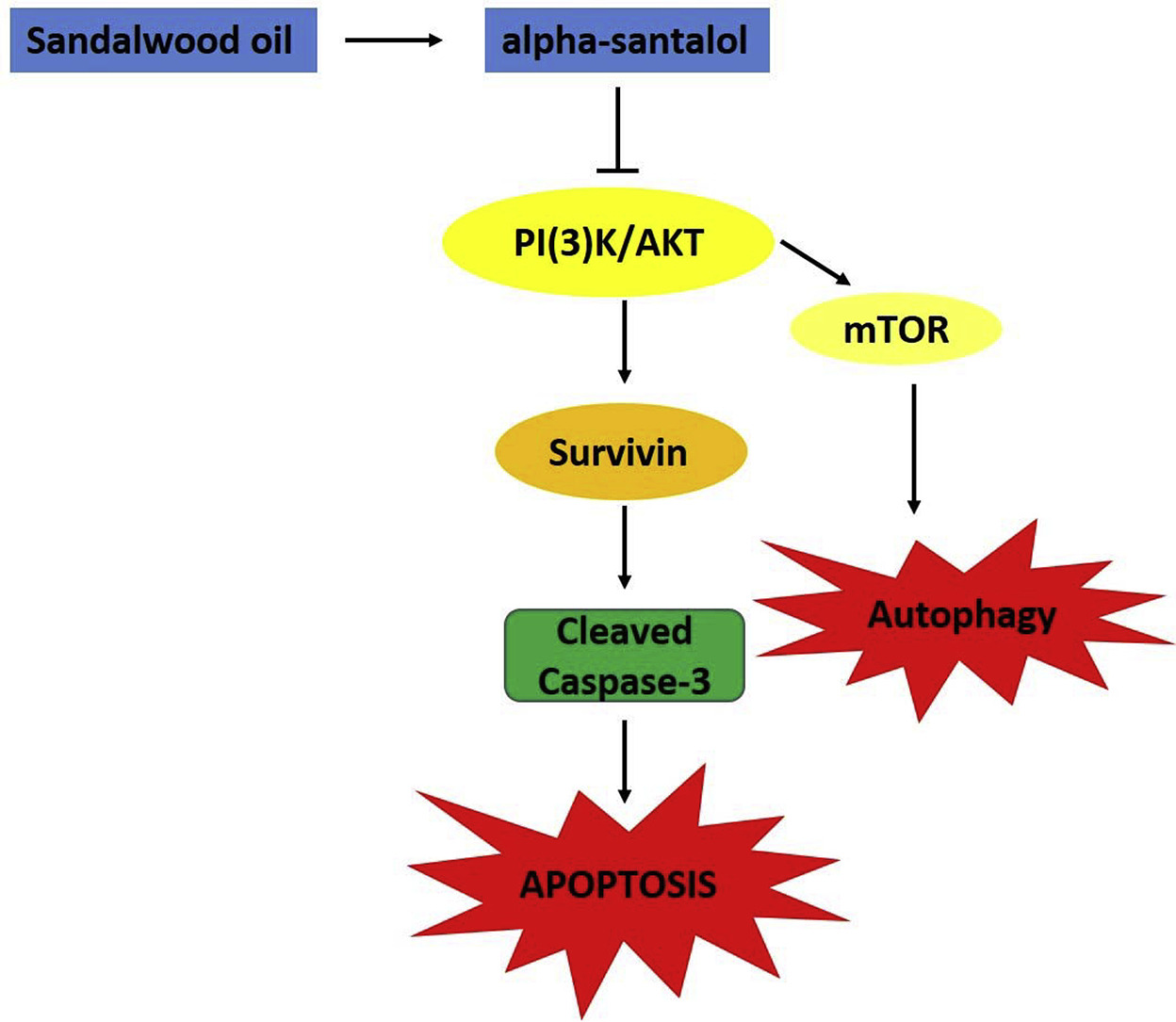
我們之前的研究表明,檀香油的主要成分α -檀香醇通過引起細胞凋亡的方式抑制體外培養(yǎng)的前列腺癌細胞的生長,但其細胞死亡的機制尚未完全闡明。本研究通過培養(yǎng)LNCaP和PC-3人前列腺癌細胞,探討PI3K/Akt/survivin通路在α -檀香醇誘導(dǎo)的細胞凋亡中的作用。α -檀香醇(20、40 μM)治療前列腺癌細胞后,survivin和p-AKT (s-473)表達下調(diào),survivin酶聯(lián)免疫吸附試驗結(jié)果顯示,survivin總水平顯著降低。此外,藥物抑制劑LY294002抑制PI3K-Akt通路可促進α -檀香醇誘導(dǎo)的凋亡細胞死亡,這取決于細胞活力、細胞形態(tài)、活化caspase-3活性以及cleaved PARP表達、cleaved caspase-3水平。總之,本研究為α -檀香醇誘導(dǎo)細胞死亡的分子通路提供了新的視角,并揭示了α -檀香醇靶向Akt/Survivin通路誘導(dǎo)細胞死亡,并且在該通路的已知抑制劑存在下,細胞死亡增加。[3]
首先采用96孔微量滴定板分析法進行抗酪氨酸酶活性測試,該方法選擇蘑菇酪氨酸酶(一種用于篩選和表征潛在酪氨酸酶抑制劑的流行靶酶)。結(jié)果顯示檀香精油具有抗酪氨酸酶活性(IC50, 174 μg mL-1),其效力與黃酮類化合物熊果苷(IC50, 149 μg mL-1)相當。(說明:熊果苷為護膚品中常見美白活性成分,它同樣可抑制酪氨酸酶活性。)薄層色譜-生物自顯影(TLC-bioautography)實驗表明,檀香精油的主要成分α-檀香醇對酪氨酸酶活性具有抑制作用。然而,還不能確定第二豐富的成分β-檀香醇是否是抑制酪氨酸酶的活性成分。進一步與參比化合物對比發(fā)現(xiàn),α-檀香醇(50 μg mL-1)對酪氨酸酶的抑制作用比曲酸(1 μg mL-1)高約2.5倍。96孔微量滴定板分析顯示了檀香精油的抗膽堿酯酶潛力,且其對AChE的抑制能力(IC50, 4.8 μg mL-1)比對BChE的抑制能力(IC50, 58 μg mL-1)高11倍。薄層色譜-生物自顯影(TLC-bioautography)實驗表明,檀香精油中除α-檀香醇外,其他成分均無抑制作用。α-檀香醇在50 μg mL-1時對膽堿酯酶的抑制作用與毒扁豆堿(1 μg mL-1)相當,甚至更強。檀香精油及其主要成分α-檀香醇具有抗酪氨酸酶和抗膽堿酯酶活性,在治療阿爾茨海默氏病以及皮膚美白方面具有很大的應(yīng)用潛力。綜上所述,α-檀香醇具有作為酪氨酸酶抑制劑和膽堿酯酶抑制劑的組合藥理學(xué)潛力。[4]
東印度檀香油已被廣泛用作阿育吠陀的藥物,具有多種藥理特性。然而,東印度檀香油對氧化應(yīng)激引起的損害的抗氧化和抗應(yīng)激效力仍未得到探索。因此,本研究旨在研究從人工種植的Santalum album L.的心材中提取的精油(SEO)的體外和體內(nèi)抗氧化和壓力保護特性。SEO是通過傳統(tǒng)的流式蒸餾法提取的,其化學(xué)成分通過氣相色譜-質(zhì)譜(GC-MS)分析測定。通過GC-MS鑒定了19種化學(xué)成分,占總油量的96.81%。主要成分是α-檀香醇(41.77%)、β-檀香醇(18.02%)、(Z)-α-反式佛手甘醇(8.50%)、(Z)-澳白檀醇(6.57%)和表β-檀香醇(5.78%)。體外研究結(jié)果表明,SEO具有良好的抗氧化活性,因為它能夠抑制細胞內(nèi)活性氧(ROS)的產(chǎn)生,扭轉(zhuǎn)形態(tài)學(xué)上的損傷,并有效地提高神經(jīng)細胞在氧化應(yīng)激條件下的生存能力。此外,SEO明顯提高了超氧化物歧化酶、過氧化氫酶和谷胱甘肽過氧化物酶的抗氧化酶活性。Western blotting結(jié)果進一步證實,SEO可能通過激活核因子-紅細胞2-相關(guān)因子2/血紅素加氧酶-1(Nrf2/HO-1)的抗氧化機制來保護神經(jīng)細胞免受氧化損傷。SEO對尹秀麗桿線蟲也表現(xiàn)出強烈的體內(nèi)抗氧化和壓力調(diào)節(jié)活性。SEO不僅對氧化應(yīng)激起保護作用,而且還延長了mev-1突變體尹秀麗桿線蟲的壽命,該突變體由于過度產(chǎn)生ROS而導(dǎo)致壽命縮短。這些數(shù)據(jù)證實,SEO可能通過直接清除自由基和激活抗氧化防御系統(tǒng),在體外和體內(nèi)發(fā)揮了強大的抗氧化和壓力調(diào)節(jié)活動。這些研究結(jié)果表明,SEO具有作為抗氧化劑來源的潛力,可用于治療由氧化應(yīng)激引起的一些變性和疾病狀況。[5]
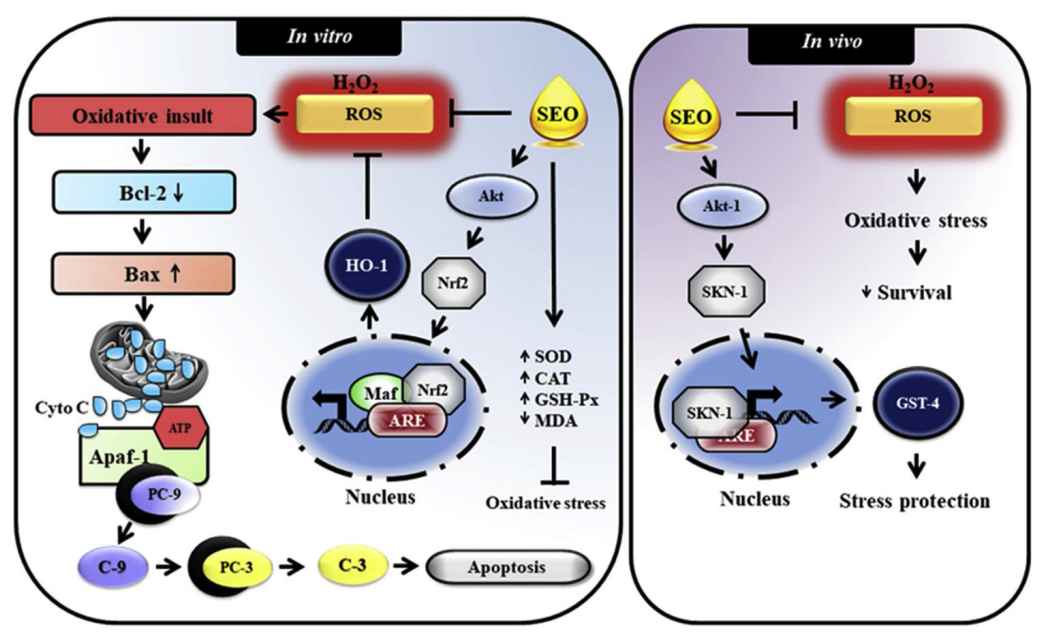
提出了從人工種植的S. album樹木中提取的SEO的抗氧化和壓力保護功效。SEO的直接抗氧化活性分別抑制了人類神經(jīng)細胞和優(yōu)雅動物中ROS介導(dǎo)的細胞凋亡和生存率下降。除了直接的抗氧化活性外,SEO還能提高抗氧化酶的活性,并明顯降低神經(jīng)細胞在氧化應(yīng)激條件下的脂質(zhì)過氧化水平。此外,SEO可能通過Akt介導(dǎo)的Nrf2依賴性抗氧化途徑來抵御體外和體內(nèi)的壓力。[5]
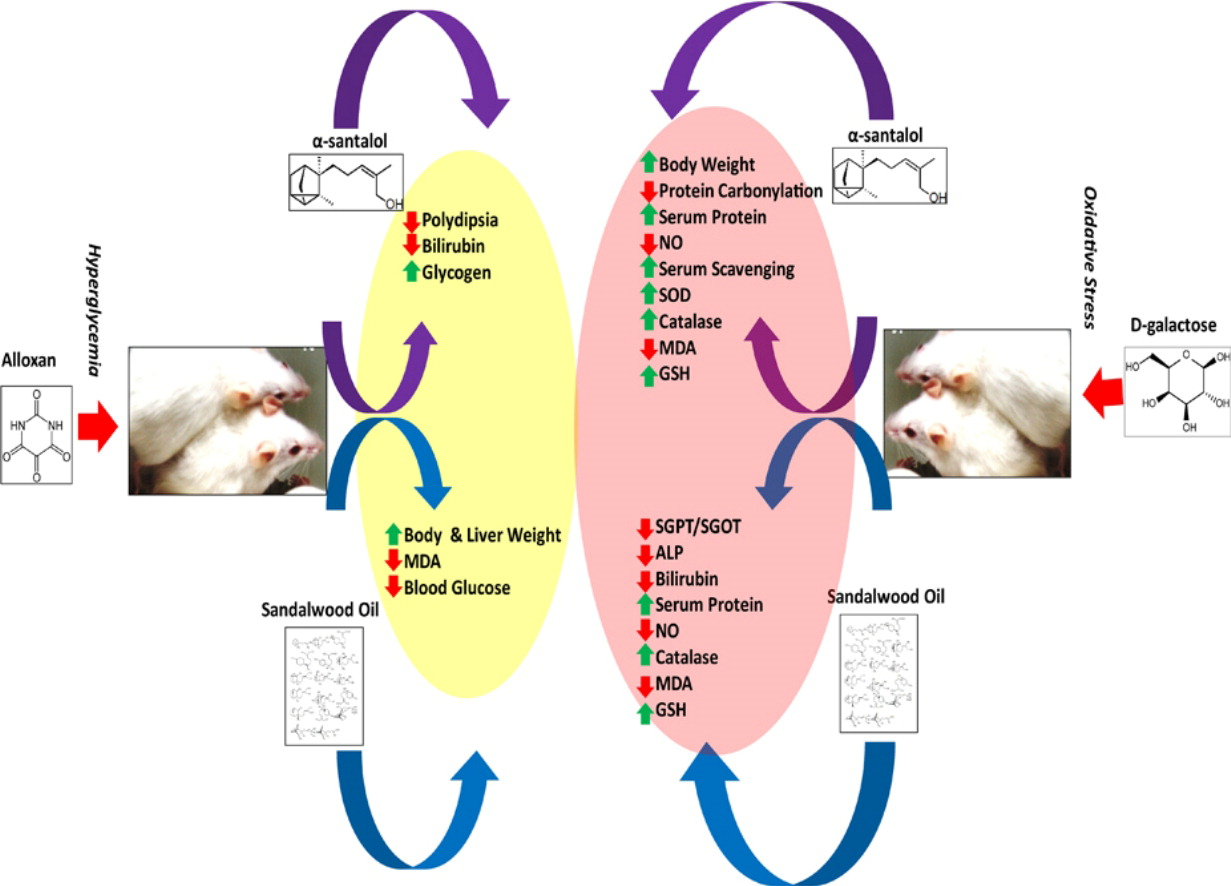
檀香在全世界的傳統(tǒng)醫(yī)藥系統(tǒng)中被大量提及。本研究的目的是評估檀香油及其主要成分α-檀香醇的體內(nèi)抗高血糖和抗氧化潛力。體內(nèi)抗高血糖實驗是在四氧嘧啶誘導(dǎo)的糖尿病雄性瑞士白化病小鼠模型中進行的。體內(nèi)抗氧化實驗是在D-半乳糖介導(dǎo)的氧化應(yīng)激誘導(dǎo)的雄性瑞士白化病小鼠模型中進行的。腹腔注射α-檀香醇(100毫克/公斤體重)和檀香油(1克/公斤體重)一周后,將四氧嘧啶誘導(dǎo)的糖尿病小鼠的體重、血糖、血清膽紅素、肝糖原和脂質(zhì)過氧化物含量等參數(shù)調(diào)節(jié)到正常血糖水平。同樣,腹腔注射α-檀香醇(100毫克/公斤體重)和檀香油(1克/公斤體重)兩周,可以調(diào)節(jié)血清轉(zhuǎn)氨酶、堿性磷酸酶、膽紅素、超氧化物歧化酶、過氧化氫酶、游離巰基、蛋白質(zhì)羰基、一氧化氮、肝臟過氧化脂質(zhì)含量和d-半乳糖介導(dǎo)的氧化壓力誘導(dǎo)的小鼠的抗氧化能力等參數(shù)。此外,據(jù)觀察,α-檀香醇的有益作用得到了很好的補充,與檀香油中存在的其他成分不同,從而表明這種傳統(tǒng)使用的生物資源的生物活性具有協(xié)同作用。[6]
參考文獻:
[1] Zha, Wen-long, Zi, Jia-chen. Advances in biotechnological production of santalenes and santalols. Chinese Herbal Medicines, 2021, 13, 90-97.
[2] Amirthalingam Mohankumar, Duraisamy Kalaiselvi, Govindhan Thiruppathi, Sivaramakrishnan Muthusaravanan, Sundararaj Nivitha, Corey Levenson, Shinkichi Tawata, and Palanisamy Sundararaj. α- and β-Santalols Delay Aging in Caenorhabditis elegans via Preventing Oxidative Stress and Protein Aggregation. ACS Omega 2020 5 (50), 32641-32654.DOI: 10.1021/acsomega.0c05006.
[3] Ajay Bommareddy, Danielle McGlynn, Marissa Lewis, Lauren Lockus, Jonathan Seward, Ka Lok Hong, Adam L. VanWert, Chandradhar Dwivedi,Akt/survivin pathway inhibition enhances the apoptotic cell death-induced by alpha-santalol in human prostate cancer cells, Fitoterapia,2020,143,104552,DOI:10.1016/j.fitote.2020.104552.
[4] Misra BB, Dey S. TLC-bioautographic evaluation of in vitro anti-tyrosinase and anti-cholinesterase potentials of sandalwood oil. Nat Prod Commun. 2013 Feb;8(2):253-6.
[5] A., Mohankumar; D., Kalaiselvi; C., Levenson; G., Shanmugam; G., Thiruppathi; S., Nivitha; P., Sundararaj. Antioxidant and stress modulatory efficacy of essential oil extracted from plantation-grown Santalum album L.. Industrial Crops and Products, 2019, 140, 111623. DOI:10.1016/j.indcrop.2019.111623
[6] Biswapriya B. Misra, Satyahari Dey, Evaluation of in vivo anti-hyperglycemic and antioxidant potentials of α-santalol and sandalwood oil, Phytomedicine, 2013, 20(5),409-416,DOI: 10.1016/j.phymed.2012.12.017.